Aldosteron hos mennesker er hovedrepresentanten for mineralokortikoidhormoner avledet fra kolesterol.
Syntese
Det utføres i den glomerulære sonen i binyrebarken. Progesteron, dannet av kolesterol, gjennomgår sekvensiell oksidasjon på vei til aldosteron. 21-hydroksylase, 11-hydroksylase og 18-hydroksylase. Til syvende og sist dannes aldosteron.

Plan for syntese av steroidhormoner (komplett skjema)
Regulering av syntese og sekresjon
Aktiver:
- angiotensin II frigjøres under aktivering av renin-angiotensin-systemet,
- økt konsentrasjon kaliumioner i blodet (assosiert med membrandepolarisering, åpning av kalsiumkanaler og aktivering av adenylatcyklase).
Aktivering av renin-angiotensin-systemet
- Det er to utgangspunkt for å aktivere dette systemet:
- trykkreduksjon i de afferente arteriolene i nyrene, som bestemmes baroreseptorer celler i det juxtaglomerulære apparatet. Årsaken til dette kan være ethvert brudd på nyreblodstrømmen - aterosklerose i nyrearteriene, økt blodviskositet, dehydrering, blodtap, etc.
- reduksjon i konsentrasjonen av Na + ioner i den primære urinen i nyrenes distale tubuli, som bestemmes av osmoreseptorene til cellene i det juxtaglomerulære apparatet. Oppstår som et resultat av et saltfritt kosthold, ved langvarig bruk av vanndrivende midler.
Utskillelsen av renin (basisk) opprettholdes av det sympatiske nervesystemet, konstant og uavhengig av renal blodstrøm.
- Når du utfører ett eller begge elementene i cellen juxtaglomerulært apparat aktiveres og fra dem skilles enzymet ut i blodplasmaet renin.
- Det er et substrat for renin i plasma - et protein av α2-globulinfraksjonen angiotensinogen. Som et resultat av proteolyse kalles et dekapeptid angiotensin I. Videre angiotensin I med deltakelse angiotensin-konverterende enzym(ACE) blir til angiotensin II.
- Hovedmålene for angiotensin II er glatte myocytter. blodårer og glomerulær cortex binyrene:
- stimulering av blodårer forårsaker deres spasmer og restitusjon blodtrykk.
- utskilles fra binyrene etter stimulering aldosteron virker på de distale tubuliene i nyrene.
Ved eksponering for aldosteron øker tubuli i nyrene reabsorpsjonen Na + ioner, etter natriumbevegelser vann. Som et resultat gjenopprettes trykket i sirkulasjonssystemet og konsentrasjonen av natriumioner øker i blodplasmaet og derfor i primærurinen, noe som reduserer aktiviteten til RAAS.

Aktivering av renin-angiotensin-aldosteron-systemet
Virkningsmekanismen
Cytosolisk.
Mål og effekter
Det påvirker spyttkjertlene, de distale tubuli og samlingskanalene i nyrene. Forbedringer i nyrene reabsorpsjon av natriumioner og tap av kaliumioner gjennom følgende effekter:
- øker mengden av Na +, K + -ATPase på basalmembranen til epitelceller,
- stimulerer syntesen av mitokondrielle proteiner og en økning i mengden energi som produseres i cellen for driften av Na +, K + -ATPase,
- stimulerer dannelsen av Na-kanaler på den apikale membranen til nyreepitelceller.
Patologi
hyperfunksjon
Conn syndrom(primær aldosteronisme) - forekommer med adenomer i den glomerulære sonen. Det er preget av en triade av tegn: hypertensjon, hypernatremi, alkalose.
Sekundær hyperaldosteronisme - hyperplasi og hyperfunksjon av juxtaglomerulære celler og overdreven sekresjon av renin og angiotensin II. Det er en økning i blodtrykket og utseendet til ødem.
Som dannes i spesielle celler i det juxtaglomerulære apparatet til nyren (JUGA). Utskillelsen av renin stimuleres av en reduksjon i volumet av sirkulerende blod, en reduksjon i blodtrykk, b 2 -agonister, prostaglandiner E 2, I 2, kaliumioner. En økning i reninaktivitet i blodet forårsaker dannelsen av angiotensin I - et 10-aminosyrepeptid som spaltes fra angiotensinogen. Angiotensin I under påvirkning av angiotensin-konverterende enzym (ACE) i lungene og i blodplasma omdannes til angiotensin II.
Det forårsaker syntese av hormonet aldosteron i den glomerulære sonen i binyrebarken. Aldosteron kommer inn i blodet, transporteres til nyrene og virker gjennom sine reseptorer på de distale tubuliene i nyremargen. Den totale biologiske effekten av aldosteron er retensjon av NaCl, vann. Som et resultat gjenopprettes volumet av væske som sirkulerer i sirkulasjonssystemet, inkludert en økning i nyreblodstrømmen. Dette lukker den negative tilbakemeldingen og reninsyntesen stopper. I tillegg forårsaker aldosteron tap av Mg 2+ , K + , H + med urin Normalt opprettholder dette systemet blodtrykket (fig. 25).
Ris. 25. Renin-angiotensin-aldoster system
For mye aldosteron - aldosteronisme , er primær og sekundær. Primær aldosteronisme kan være forårsaket av hypertrofi av den glomerulære sonen i binyrene, endokrin epitologi, svulst (aldosteronom). Sekundær aldosteronisme observeres ved leversykdommer (aldosteron nøytraliseres ikke og skilles ikke ut), eller ved sykdommer i det kardiovaskulære systemet, som et resultat av at blodtilførselen til nyrene forverres.
Resultatet er det samme - hypertensjon, og i den kroniske prosessen forårsaker aldosteron spredning, hypertrofi og fibrose av blodkar og myokard (ombygging), noe som fører til kronisk hjertesvikt. Hvis det er assosiert med et overskudd av aldosteron, er aldosteronreseptorblokkere foreskrevet. For eksempel er spironolakton, eplerenon kaliumsparende diuretika, de fremmer utskillelsen av natrium og vann.
Hypoaldosteronisme er mangel på aldosteron som oppstår ved visse sykdommer. Årsakene til primær hypoaldosteronisme kan være tuberkulose, autoimmun betennelse i binyrene, tumormetastaser og brå seponering av steroider. Som regel er dette insuffisiens av hele binyrebarken. Akutt svikt kan være forårsaket av glomerulær nekrose, blødning eller akutt infeksjon. Hos barn kan en fulminant form observeres i mange infeksjonssykdommer (influensa, meningitt), når et barn kan dø på en dag.
Med insuffisiens av den glomerulære sonen reduseres reabsorpsjonen av natrium og vann, volumet av sirkulerende plasma reduseres; øker reabsorpsjonen av K + , H + . Som et resultat faller blodtrykket kraftig, elektrolyttbalansen og syre-basebalansen forstyrres, tilstanden er livstruende. Behandling: intravenøs saltvann og aldosteronagonister (fludrokortison).
Nøkkelleddet i RAAS er angiotensin II, som:
Virker på den glomerulære sonen og øker sekresjonen av aldosteron;
Virker på nyrene og forårsaker retensjon av Na + , Cl - og vann;
Virker på sympatiske nevroner og forårsaker frigjøring av noradrenalin, en kraftig vasokonstriktor;
Forårsaker vasokonstriksjon - trekker sammen blodårene (tivis av ganger mer aktiv enn noradrenalin);
Stimulerer saltappetitt og tørst.
Dermed bringer dette systemet blodtrykket til det normale når det synker. Overskudd av angiotensin II påvirker hjertet, så vel som et overskudd av CA og tromboksaner, forårsaker myokardhypertrofi og fibrose, bidrar til hypertensjon og kronisk hjertesvikt.
Med en økning i blodtrykket begynner tre hormoner å virke hovedsakelig: NUP (natriuretiske peptider), dopamin, adrenomedullin. Effekten deres er motsatt av effekten av aldosteron og AT II. NUP forårsaker utskillelse av Na + , Cl - , H 2 O, vasodilatasjon, øker vaskulær permeabilitet og reduserer dannelsen av renin.
Adrenomedullin virker på samme måte som NUP: det er utskillelse av Na +, Cl -, H 2 O, vasodilatasjon. Dopamin syntetiseres av de proksimale tubuli i nyrene og fungerer som et parakrint hormon. Dens effekter: utskillelse av Na + og H 2 O. Dopamin reduserer syntesen av aldosteron, virkningen av angiotensin II og aldosteron, forårsaker vasodilatasjon og en økning i nyreblodstrømmen. Sammen fører disse effektene til en reduksjon i blodtrykket.
Blodtrykksnivået avhenger av mange faktorer: hjertets arbeid, tonen i perifere kar og deres elastisitet, samt volumet av elektrolyttsammensetningen og viskositeten til det sirkulerende blodet. Alt dette styres av nerve- og humorsystemet. Hypertensjon i prosessen med kronisering og stabilisering er assosiert med sene (kjernefysiske) effekter av hormoner. I dette tilfellet oppstår vaskulær ombygging, deres hypertrofi og spredning, vaskulær og myokardiell fibrose.
For tiden er effektive antihypertensive medisiner hemmere av vasopeptidase ACE og nøytral endopeptidase. Nøytral endopeptidase er involvert i ødeleggelsen av bradykinin, NUP, adrenomedullin. Alle tre peptidene er vasodilatorer, reduserer blodtrykket. For eksempel reduserer ACE-hemmere (perindo-, enalopril) blodtrykket ved å redusere dannelsen av AT II og forsinke nedbrytningen av bradykinin.
Nøytrale endopeptidasehemmere (omapatrilat), som både er ACE-hemmere og nøytrale endopeptidasehemmere, har blitt oppdaget. De reduserer ikke bare dannelsen av AT II, men forhindrer også nedbrytningen av hormoner som reduserer blodtrykket - adrenomedullin, NUP, bradykinin. ACE-hemmere slår ikke helt av RAAS. En mer fullstendig avstenging av dette systemet kan oppnås med angiotensin II-reseptorblokkere (losartan, eprosartan).
For sitering: Leonova M.V. Nye og lovende legemidler som blokkerer renin-angiotensin-aldosteron-systemet // RMJ. Medisinsk gjennomgang. 2013. nr. 17. S. 886
Rollen til renin-angiotensin-aldosteron-systemet (RAAS) i utviklingen av arteriell hypertensjon (AH) og andre kardiovaskulære sykdommer anses for tiden å være dominerende. I det kardiovaskulære kontinuumet er hypertensjon blant risikofaktorene, og den viktigste patofysiologiske mekanismen for skade på det kardiovaskulære systemet er angiotensin II (ATII). ATII er en nøkkelkomponent i RAAS - en effektor som implementerer vasokonstriksjon, natriumretensjon, aktivering av det sympatiske nervesystemet, celleproliferasjon og hypertrofi, utvikling av oksidativt stress og betennelse i vaskulærveggen.
For tiden er to klasser av legemidler som blokkerer RAAS allerede utviklet og mye brukt klinisk - ACE-hemmere og ATII-reseptorblokkere. De farmakologiske og kliniske effektene av disse klassene er forskjellige. ACE er en sinkmetalloproteinasepeptidase som metaboliserer ATI, AT1-7, bradykinin, substans P og mange andre peptider. Virkningsmekanismen til ACE-hemmere er hovedsakelig assosiert med forebygging av dannelsen av ATII, som fremmer vasodilatasjon, natriurese og eliminerer de pro-inflammatoriske, proliferative og andre effektene av ATII. I tillegg forhindrer ACE-hemmere nedbrytningen av bradykinin og øker nivået. Bradykinin er en kraftig vasodilator, potenserer natriurese, og viktigst av alt, har den kardiobeskyttende (forhindrer hypertrofi, reduserer iskemisk skade på myokard, forbedrer koronar blodtilførsel) og vasoprotektiv virkning, og forbedrer endotelfunksjonen. Samtidig er et høyt nivå av bradykinin årsaken til utviklingen av angioødem, som er en av de alvorlige ulempene med ACE-hemmere, som øker nivået av kininer betydelig.
ACE-hemmere er ikke alltid i stand til å fullstendig blokkere dannelsen av ATII i vev. Det er nå fastslått at andre enzymer som ikke er assosiert med ACE, først og fremst endopeptidaser, som ikke påvirkes av ACE-hemmere, også kan delta i transformasjonen i vev. Som et resultat kan ikke ACE-hemmere fullstendig eliminere effekten av ATII, noe som kan være årsaken til deres manglende effektivitet.
Løsningen på dette problemet ble forenklet av oppdagelsen av ATII-reseptorer og den første klassen medikamenter som selektivt blokkerer AT1-reseptorer. Gjennom AT1-reseptorer realiseres de ugunstige effektene av ATII: vasokonstriksjon, sekresjon av aldosteron, vasopressin, noradrenalin, væskeretensjon, spredning av glatte muskelceller og kardiomyocytter, aktivering av SAS, samt den negative tilbakemeldingsmekanismen - dannelsen av renin . AT2-reseptorer utfører "gunstige" funksjoner, som vasodilatasjon, reparasjons- og regenerasjonsprosesser, antiproliferativ virkning, differensiering og utvikling av embryonalt vev. De kliniske effektene av ATII-reseptorblokkere medieres gjennom eliminering av de "skadelige" effektene av ATII på nivået av AT1-reseptorer, noe som gir en mer fullstendig blokkering av de negative effektene av ATII og en økning i effekten av ATII på AT2-reseptorer. , som utfyller de vasodilaterende og antiproliferative effektene. ATII-reseptorblokkere har en spesifikk effekt på RAAS uten å forstyrre kininsystemet. Mangelen på påvirkning på aktiviteten til kininsystemet reduserer på den ene siden alvorlighetsgraden av uønskede effekter (hoste, angioødem), men på den annen side fratar ATII-reseptorblokkere en viktig anti-iskemisk og vasoprotektiv effekt, som skiller dem fra ACE-hemmere. Av denne grunn gjentar indikasjonene for bruk av ATII-reseptorblokkere i flertallet indikasjonene for utnevnelse av ACE-hemmere, noe som gjør dem til alternative legemidler.
Til tross for introduksjonen av RAAS-blokkere i den utbredte praksisen for behandling av hypertensjon, gjenstår problemer med å forbedre utfall og prognose. Disse inkluderer: muligheten for å forbedre blodtrykkskontrollen i befolkningen, effektiviteten av behandlingen av resistent hypertensjon, muligheten for ytterligere å redusere risikoen for kardiovaskulær sykdom.
Jakten på nye måter å påvirke RAAS på pågår aktivt; andre tett interagerende systemer studeres og legemidler med flere virkningsmekanismer utvikles, slik som ACE og nøytral endopeptidase (NEP)-hemmere, endotelinkonverterende enzym (EPF) og NEP-hemmere, ACE/NEP/EPF-hemmere.
Vasopeptidasehemmere
I tillegg til det velkjente ACE inkluderer vasopeptidaser 2 andre sinkmetalloproteinaser - neprilysin (nøytral endopeptidase, NEP) og endotelinkonverterende enzym, som også kan være mål for farmakologiske effekter.
Neprilysin er et enzym produsert av det vaskulære endotelet og er involvert i nedbrytningen av natriuretisk peptid, så vel som bradykinin.
Det natriuretiske peptidsystemet er representert av tre forskjellige isoformer: atrialt natriuretisk peptid (A-type), hjernenatriuretisk peptid (B-type), som syntetiseres i atrium og myokard, og endotel C-peptid, som er endogene RAAS-hemmere i deres biologiske funksjoner og endotelin-1 (tabell 1). De kardiovaskulære og renale effektene av natriuretisk peptid er å redusere blodtrykket gjennom effekten på vaskulær tonus og vann- og elektrolyttbalanse, samt antiproliferative og antifibrotiske effekter på målorganer. Senest er det natriuretiske peptidsystemet involvert i metabolsk regulering av lipidoksidasjon, adipocyttdannelse og -differensiering, adiponektinaktivering, insulinsekresjon og karbohydrattoleranse, noe som kan gi beskyttelse mot utviklingen av det metabolske syndromet.
Til dags dato har det blitt kjent at utviklingen av hjerte- og karsykdommer er assosiert med dysregulering av det natriuretiske peptidsystemet. Så ved hypertensjon er det en mangel på natriuretisk peptid, noe som fører til saltfølsomhet og nedsatt natriurese; ved kronisk hjertesvikt (CHF), på bakgrunn av mangel, observeres en unormal funksjon av hormonene i det natriuretiske peptidsystemet.
Derfor kan NEP-hemmere brukes til å potensere det natriuretiske peptidsystemet for å oppnå ytterligere hypotensive og beskyttende kardiorenale effekter. Hemming av neprilysin fører til potensering av de natriuretiske, diuretiske og vasodilaterende effektene av endogent natriuretisk peptid og som et resultat til en reduksjon i blodtrykket. Imidlertid er NEP også involvert i nedbrytningen av andre vasoaktive peptider, spesielt ATI, ATII og endotelin-1. Derfor er balansen mellom effekter på vaskulær tonus av NEP-hemmere variabel og avhenger av overvekt av sammentrekkende og dilaterende effekter. Ved langvarig bruk er den antihypertensive effekten av neprilysinhemmere svakt uttrykt på grunn av kompenserende aktivering av dannelsen av ATII og endotelin-1.
I denne forbindelse kan kombinasjonen av effektene av ACE-hemmere og NEP-hemmere betydelig potensere hemodynamiske og antiproliferative effekter som et resultat av en komplementær virkningsmekanisme, som førte til opprettelsen av legemidler med en dobbel virkningsmekanisme, samlet under navnet - vasopeptidase-inhibitorer (tabell 2, fig. 1).
Kjente inhibitorer av vasopeptidaser er karakterisert ved varierende grader av selektivitet for NEP/ACE: omapatrilat - 8,9:0,5; fazidoprilat - 5,1:9,8; sampatrilat - 8.0:1.2. Som et resultat fikk vasopeptidasehemmere mye større muligheter til å oppnå en hypotensiv effekt, uavhengig av aktiviteten til RAAS og nivået av natriumretensjon, og i organbeskyttelse (regresjon av hypertrofi, albuminuri, vaskulær stivhet). Det mest studerte i kliniske studier var omapatrilat, som viste en høyere antihypertensiv effekt sammenlignet med ACE-hemmere, og hos pasienter med CHF førte til en økning i ejeksjonsfraksjon og forbedret klinisk utfall (IMPRESS, OVERTURE-studier), men uten fordeler i forhold til ACE-hemmere.
I store kliniske studier med bruk av omapatrilat ble det imidlertid funnet en høyere forekomst av angioødem sammenlignet med ACE-hemmere. Det er kjent at forekomsten av angioødem ved bruk av ACE-hemmere er fra 0,1 til 0,5 % i befolkningen, hvorav 20 % av tilfellene er livstruende, noe som er assosiert med en multippel økning i konsentrasjonen av bradykinin og dets metabolitter. Resultatene fra en stor multisenterstudie OCTAVE (n=25 302), som var spesielt utviklet for å studere forekomsten av angioødem, viste at forekomsten av denne bivirkningen under behandling med omapatrilat overstiger den i enalaprilgruppen - 2,17 % vs. 0,68 % (relativ risiko 3.4). Dette ble forklart av den økte effekten på nivået av kininer under synergistisk hemming av ACE og NEP, assosiert med hemming av aminopeptidase P, som er involvert i nedbrytningen av bradykinin.
En ny dobbel ACE/NEP-blokkerende vasopeptidasehemmer, ilepatril, har høyere affinitet for ACE enn NEP. Når man studerte de farmakodynamiske effektene av ilepatril på effekten på aktiviteten til RAAS og natriuretisk peptid hos friske frivillige, ble det funnet at stoffet doseavhengig (ved doser på 5 og 25 mg) og signifikant (mer enn 88%) undertrykker ACE i plasma i mer enn 48 timer, uavhengig av saltfølsomhet. Samtidig økte stoffet betydelig plasmareninaktivitet i 48 timer og reduserte nivået av aldosteron. Disse resultatene viste en uttalt og lengre undertrykkelse av RAAS, i motsetning til ACE-hemmeren ramipril ved en dose på 10 mg, som ble forklart av en mer signifikant vevseffekt av ilepatril på ACE og en større affinitet for ACE, og en sammenlignbar grad av blokkering av RAAS sammenlignet med kombinasjonen av irbesartan 150 mg + 10 mg ramipril. I motsetning til effekten på RAAS, ble effekten av ilepatril på det natriuretiske peptidet manifestert ved en forbigående økning i nivået av dets utskillelse i perioden 4-8 timer etter en dose på 25 mg, noe som indikerer en lavere og svakere affinitet for NEP og skiller det fra omapatrilat. Dessuten, når det gjelder nivået av elektrolyttutskillelse, har ikke stoffet en ekstra natriuretisk effekt sammenlignet med ramipril eller irbesartan, så vel som andre vasopeptidasehemmere. Den maksimale hypotensive effekten utvikles 6-12 timer etter inntak av stoffet, og reduksjonen i gjennomsnittlig blodtrykk er 5±5 og 10±4 mm Hg. ved henholdsvis lav og høy saltfølsomhet. I henhold til de farmakokinetiske egenskapene er ilepatril et prodrug med en aktiv metabolitt, som raskt dannes med en maksimal konsentrasjon på 1-1,5 timer og elimineres sakte. Fase III kliniske studier pågår for tiden.
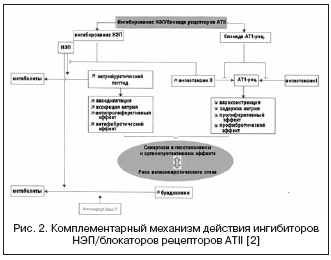
En alternativ vei til dobbel undertrykkelse av RAAS og NEP er representert ved en kombinasjon av blokkering av ATII-reseptorer og NEP (fig. 2). ATII-reseptorblokkere påvirker ikke metabolismen av kininer, i motsetning til ACE-hemmere, derfor har de potensielt lavere risiko for å utvikle angioødem. For tiden gjennomgår det første stoffet, en ATII-reseptorblokker med virkningen å hemme NEP i forholdet 1:1, LCZ696, fase III kliniske studier. Det kombinerte legemiddelmolekylet inneholder valsartan og en NEP-hemmer (AHU377) i form av et prodrug. I en stor studie på pasienter med hypertensjon (n=1328) viste LCZ696 i doser på 200-400 mg en fordel i den hypotensive effekten fremfor valsartan ved doser på 160-320 mg i form av en ytterligere reduksjon i blodtrykket med 5 /3 og 6/3 mmHg. . . Den hypotensive effekten av LCZ696 ble ledsaget av en mer uttalt reduksjon i pulstrykk: med 2,25 og 3,32 mm Hg. ved doser på henholdsvis 200 og 400 mg, som i dag anses som en positiv prognostisk faktor for effekten på vaskulær veggstivhet og kardiovaskulære utfall. Samtidig viste studiet av nevrohumorale biomarkører under behandling med LCZ696 en økning i nivået av natriuretisk peptid med en sammenlignbar grad av økning i nivået av renin og aldosteron sammenlignet med valsartan. Tolerabiliteten hos pasienter med hypertensjon var god, og ingen tilfeller av angioødem ble notert. PARAMOUMT-studien er nå fullført på 685 pasienter med CHF og uhemmet EF. Resultatene av studien viste at LCZ696 reduserer nivået av NT-proBNP raskere og mer uttalt (det primære endepunktet er en markør for økt natriuretisk peptidaktivitet og dårlig prognose ved CHF) sammenlignet med valsartan, og reduserer også størrelsen på venstre atrium , som indikerer en regresjon av ombyggingen. En studie på pasienter med CHF og redusert EF pågår (PARADIGM-HF-studien).
Endotelinsystemhemmere
Endotelinsystemet spiller en viktig rolle i reguleringen av vaskulær tonus og regional blodstrøm. Blant de tre kjente isoformene er endotelin-1 den mest aktive. I tillegg til de kjente vasokonstriktoreffektene, stimulerer endotelin proliferasjonen og syntesen av den intercellulære matrisen, og er også, på grunn av en direkte effekt på nyrekarrenes tone, involvert i reguleringen av vann- og elektrolytthomeostase. Effektene av endotelin realiseres gjennom interaksjon med spesifikke A-type og B-type reseptorer, hvis funksjoner er gjensidig motsatte: vasokonstriksjon skjer gjennom A-type reseptorer, og vasodilatasjon skjer gjennom B-typen. De siste årene har det blitt fastslått at B-type reseptorer spiller en viktig rolle i clearance av endotelin-1, dvs. blokkering av disse reseptorene forstyrrer den reseptoravhengige clearance av endotelin-1 og øker konsentrasjonen. I tillegg er B-type reseptorer involvert i reguleringen av nyreeffekten av endotelin-1 og vedlikehold av vann- og elektrolytthomeostase, noe som er viktig.
For tiden har endotelins rolle blitt bevist i utviklingen av en rekke sykdommer, inkl. AH, CHF, pulmonal hypertensjon, kronisk nyresykdom; viser en nær sammenheng mellom nivået av endotelin og metabolsk syndrom, endoteldysfunksjon og aterogenese. Siden 1990-tallet et søk pågår etter endotelinreseptorantagonister egnet for klinisk bruk; 10 medikamenter er allerede kjent ("sentans") med varierende grad av selektivitet for A/B-type reseptorer. Den første ikke-selektive endotelinreseptorantagonisten – bosentan – i en klinisk studie hos pasienter med hypertensjon viste en hypotensiv effekt som var sammenlignbar med ACE-hemmeren enalapril. Ytterligere studier på effekten av endotelinantagonister ved hypertensjon har vist deres kliniske relevans ved behandling av resistent hypertensjon og ved høy kardiovaskulær risiko. Disse dataene ble innhentet i to store kliniske studier DORADO (n=379) og DORADO-AC (n=849), der darusentan ble lagt til trippelkombinasjonsbehandling hos pasienter med resistent hypertensjon. I DORADO-studien ble pasienter med resistent hypertensjon assosiert med kronisk nyresykdom og proteinuri, og som et resultat av tillegg av darusentan ble det ikke bare observert en signifikant reduksjon i blodtrykket, men også en reduksjon i proteinutskillelse. Den antiproteinuriske effekten av endotelinreseptorantagonister ble senere bekreftet i en studie på pasienter med diabetisk nefropati som brukte avocentan. I DORADO-AC-studien var det imidlertid ingen fordel med ytterligere BP-reduksjon i forhold til komparatorer og placebo, noe som var årsaken til at ytterligere studier ble avsluttet. I tillegg, i 4 store studier av endotelinantagonister (bosentan, darusentan, enrasentan) hos pasienter med CHF, ble det oppnådd motstridende resultater, noe som ble forklart med en økning i konsentrasjonen av endotelin-1. Ytterligere studier av endotelinreseptorantagonister ble suspendert på grunn av uønskede effekter assosiert med væskeretensjon (perifert ødem, volumoverbelastning). Utviklingen av disse effektene er assosiert med effekten av endotelinantagonister på B-type reseptorer, noe som har endret søket etter medikamenter som påvirker endotelinsystemet gjennom andre veier; og endotelinreseptorantagonister har for tiden bare én indikasjon, behandling av pulmonal hypertensjon.
Tatt i betraktning den høye betydningen av endotelinsystemet i reguleringen av vaskulær tonus, pågår et søk etter en annen virkningsmekanisme gjennom vasopeptidase - EPF, som er involvert i dannelsen av aktivt endotelin-1 (fig. 3). Blokkeringen av ACE og kombinasjonen med inhibering av NEP kan effektivt undertrykke dannelsen av endotelin-1 og potensere effekten av det natriuretiske peptidet. Fordelene med en dobbel virkningsmekanisme er på den ene siden å forhindre ulempene med NEP-hemmere forbundet med mulig vasokonstriksjon mediert av endotelinaktivering, på den annen side gjør den natriuretiske aktiviteten til NEP-hemmere det mulig å kompensere for væskeretensjon assosiert med ikke-selektiv blokkering av endotelinreseptorer. Daglutril er en dobbel hemmer av NEP og EPF, som er i fase II kliniske studier. Studier har vist uttalte kardiobeskyttende effekter av stoffet på grunn av en reduksjon i hjerte- og vaskulær ombygging, regresjon av hypertrofi og fibrose.
Direkte reninhemmere
Det er kjent at ACE-hemmere og ATII-reseptorblokkere øker reninaktiviteten ved hjelp av en tilbakemeldingsmekanisme, som er årsaken til at effektiviteten til RAAS-blokkere slipper unna. Renin representerer det aller første trinnet i RAAS-kaskaden; det produseres av de juxtaglomerulære cellene i nyrene. Renin gjennom angiotensinogen fremmer dannelsen av ATII, vasokonstriksjon og sekresjon av aldosteron, og regulerer også tilbakemeldingsmekanismer. Derfor gjør reninhemming det mulig å oppnå en mer fullstendig blokade av RAAS-systemet. Letingen etter reninhemmere har pågått siden 1970-tallet; i lang tid var det ikke mulig å få en oral form for reninhemmere på grunn av deres lave biotilgjengelighet i mage-tarmkanalen (mindre enn 2%). Den første direkte reninhemmeren egnet for oral administrering, aliskiren, ble registrert i 2007. Aliskiren har lav biotilgjengelighet (2,6 %), lang halveringstid (24-40 timer), en ekstrarenal eliminasjonsvei. Farmakodynamikken til aliskiren er assosiert med en 80 % reduksjon i nivået av ATII. I kliniske studier hos pasienter med hypertensjon førte aliskiren i doser på 150-300 mg/dag til en reduksjon i SBP med 8,7-13 og 14,1-15,8 mm Hg. henholdsvis, og DBP - med 7,8-10,3 og 10,3-12,3 mm Hg. . Den hypotensive effekten av aliskiren ble observert i forskjellige undergrupper av pasienter, inkludert pasienter med metabolsk syndrom, fedme; når det gjelder alvorlighetsgrad, var den sammenlignbar med effekten av ACE-hemmere, ATII-reseptorblokkere, og en additiv effekt ble observert i kombinasjon med valsartan, hydroklortiazid og amlodipin. En rekke kliniske studier har vist organobeskyttende effekter av legemidlet: antiproteinurisk effekt hos pasienter med diabetisk nefropati (AVOID-studie, n=599), regresjon av venstre ventrikkelhypertrofi hos pasienter med hypertensjon (ALLAY-studie, n=465). I AVOID-studien, etter 3 måneders behandling med losartan i en dose på 100 mg/dag og nå målnivået for blodtrykk (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
I tillegg gjennomføres en serie kliniske studier av aliskiren i behandling av andre hjerte- og karsykdommer med en vurdering av innvirkningen på prognosen til pasienter: ALOFT (n=320), ASTRONAUT (n=1639), ATMOSFÆRE (n) =7000) studier hos pasienter med CHF, ALTITUDE-studien hos pasienter med diabetes mellitus og høy kardiovaskulær risiko, ASPIRE-studien hos pasienter med postinfarktremodellering.
Konklusjon
For å løse problemene med å forebygge kardiovaskulære sykdommer, fortsetter etableringen av nye medisiner med en kompleks multippel virkningsmekanisme, noe som muliggjør en mer fullstendig blokade av RAAS gjennom en kaskade av mekanismer for hemodynamisk og nevrohumoral regulering. De potensielle effektene av slike legemidler tillater ikke bare å gi en ekstra antihypertensiv effekt, men også å oppnå kontroll av blodtrykksnivåer hos høyrisikopasienter, inkludert resistent hypertensjon. Legemidler med en multippel virkningsmekanisme viser fordeler i en mer uttalt organoprotektiv effekt, som vil forhindre ytterligere skade på det kardiovaskulære systemet. Å studere fordelene med nye legemidler som blokkerer RAAS krever ytterligere forskning og evaluering av deres innvirkning på prognosen til pasienter med hypertensjon og andre hjerte- og karsykdommer.



Litteratur
1 Campbell D.J. Vasopeptidase-hemming: et tveegget sverd? // Hypertensjon. 2003 Vol. 41. s. 383-389.
2. Laurent S., Schlaich M., Esler M. Nye medisiner, prosedyrer og enheter for hypertensjon // Lancet. 2012. Vol. 380. S. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. Vasopeptidasehemmere: et nytt terapeutisk konsept ved hjerte- og karsykdommer? // Sirkulasjon. 2001 Vol. 104. S. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Nøytral endopeptidasehemming og det natriuretiske peptidsystemet: en utviklende strategi innen kardiovaskulær terapi // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. Sammenligning av vasopeptidasehemmer, omapatrilat og lisinopril på treningstoleranse og sykelighet hos pasienter med hjertesvikt: IMPRESS randomisert studie // Lancet. 2000 Vol. 356. S. 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. Sammenligning av omapatrilat og enalapril hos pasienter med kronisk hjertesvikt: The Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002 Vol. 106. S. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Angiotensin II-reseptorblokkere hos pasienter med ACE-hemmerindusert angioødem // Ann. Pharmacother. 2000 Vol. 34. S. 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat og enalapril hos pasienter med hypertensjon: Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) studien // Am. J. Hypertens. 2004 Vol. 17. S. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Farmakokinetikk og farmakodynamikk til vasopeptidasehemmeren AVE7688 hos mennesker // Clin. Pharmacol. Ther. 2006 Vol. 79. S. 49-61.
10. Gu J., Noe A., Chandra P. et al. Farmakokinetikk og farmakodynamikk av LCZ696, en ny dualacting angiotensin receptorneprilysin inhibitor (ARNi) // J. Clin. Pharmacol. 2010 Vol. 50. s. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Blodtrykksreduksjon med LCZ696, en ny dobbeltvirkende hemmer av angiotensin II-reseptoren og neprilysin: en randomisert, dobbeltblind, placebokontrollert, aktiv komparatorstudie // Lancet. 2010 Vol. 375. S. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. Angiotensinreseptoren neprilysinhemmeren LCZ696 ved hjertesvikt med bevart ejeksjonsfraksjon: en fase 2 dobbeltblind randomisert kontrollert studie // Lancet. 2012. Vol. 380 (9851). S. 1387-1395.
13. Levin E.R. Endoteliner // N. Engl. J. Med. 1995 Vol. 333. S. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. Endotelin-1s rolle i klinisk hypertensjon: 20 år etter // Hypertensjon. 2008 Vol. 52. S. 452-459.
15. Burnier M., Forni V. Endotelinreseptorantagonister: et sted i behandlingen av essensiell hypertensjon? // Nephrol. Slå. transplantasjon. 2011.0:1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. Effekten av en endotelinreseptorantagonist, bosentan, på blodtrykket hos pasienter med essensiell hypertensjon. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998 Vol. 338. S. 784-790.
17. Weber M.A., Black H., Bakris G. et al. En selektiv endotelinreseptorantagonist for å redusere blodtrykket hos pasienter med behandlingsresistent hypertensjon: en randomisert, dobbeltblind, placebokontrollert studie // Lancet. 2009 Vol. 374. S. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. Divergerende resultater ved bruk av klinikk og ambulerende blodtrykk: rapport om en darusentan-resistent hypertensjonsforsøk // Hypertensjon. 2010 Vol. 56. S. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan for åpenbar diabetisk nefropati // J. Am. soc. Nephrol. 2010 Vol. 21. s. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. Endotelinkonverterende enzym/nøytral endopeptidasehemmer SLV338 forhindrer hypertensiv hjerteremodellering på en blodtrykksuavhengig måte // Hypertensjon. 2011 Vol. 57. s. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Angiotensin II-suppresjon hos mennesker av teoretisk aktiv reninhemmer Aliskiren (SPP100): sammenligning med enalapril // Hypertensjon. 2002 Vol. 39(1). P. E1-8.
22. Alreja G., Joseph J. Renin og kardiovaskulær sykdom: Utslitt sti, eller ny retning? // World J. Cardiol. 2011 Vol. 3(3). S. 72-83.
23. Ingelfinger J.R. Aliskiren og dobbeltterapi ved type 2 diabetes mellitus // N. Engl. J. Med. 2008 Vol. 358(23). S. 2503-2505.
24. Pouleur A.C., Uno H., Prescott M.F., Desai A. (for ALLAY-etterforskerne). Undertrykkelse av aldosteron medierer regresjon av venstre ventrikkelhypertrofi hos pasienter med hypertensjon // J. Renin-Angiotensin-Aldosteron System. 2011 Vol. 12. S. 483-490.
25. Kelly D.J., Zhang Y., Moe G. et al. Aliskiren, en ny reninhemmer, er renobeskyttende i en modell av avansert diabetisk nefropati hos rotter // Diabetol. 2007 Vol. 50. P. 2398-2404.
Systemkomponenter
- Angiotensin I
- Angiotensin II
- Prorenin
- Angiotensin-konverterende enzym
Komponenter i Renin-angiotensin (Renin-angiotensin aldosteron) systemet
Renin-angiotensin-aldesteron-kaskade begynner med biosyntesen av preprorenin fra renin mRNA i juxtaglomerulære celler og omdannes til prorenin ved spaltning av 23 aminosyrer. I det endoplasmatiske retikulumet gjennomgår prorenin glykosylering og får en 3D-struktur som er karakteristisk for aspartatproteaser. Den ferdige formen for prorenin består av en sekvens inkludert 43 rest festet til N-terminalen av reninholdig 339-341 resten. Det antas at en ytterligere proreninsekvens (prosegment) er assosiert med renin for å forhindre interaksjon med angiotensinogen. Det meste av prorenin frigjøres fritt til den systemiske sirkulasjonen ved eksocytose, men noe omdannes til renin ved virkningen av endopeptidaser i de sekretoriske granulene til juxtaglomerulære celler. Renin, dannet i sekretoriske granuler, frigjøres deretter til blodet, men denne prosessen styres tett av trykk, Ang 2, NaCl, gjennom intracellulære konsentrasjoner av kalsiumioner. Derfor, hos friske mennesker, er volumet av sirkulerende prorenin ti ganger høyere enn konsentrasjonen av aktivt renin i plasma. Det er imidlertid fortsatt uklart hvorfor konsentrasjonen av den inaktive forløperen er så høy.
Renin sekresjon kontroll
Aktiv sekresjon av renin reguleres av fire uavhengige faktorer:
- nyrebaroreseptormekanisme i den afferente arteriolen, som oppdager endringer i nyreperfusjonstrykket.
- Endringer i nivået av NaCl i det distale nefronet. Denne strømmen måles som en endring i konsentrasjonen av Cl - celler i macula densa av den distale sammenviklede tubuli av nefron i området ved siden av nyrelegemet.
- Stimulering av sympatiske nerver via beta-1 adrenerge reseptorer.
- Negativ tilbakemeldingsmekanisme implementert gjennom den direkte virkningen av angiotensin 2 på juxtaglomerulære celler. Reninsekresjon aktiveres av en reduksjon i perfusjonstrykk eller NaCl-nivå og en økning i sympatisk aktivitet. Renin syntetiseres også i andre vev, inkludert hjernen, binyrene, eggstokkene, fettvev, hjerte og blodårer.
Kontroll av reninsekresjon er en avgjørende faktor i aktiviteten til RAAS.
Virkningsmekanisme til renin-angiotensin-systemet
Renin regulerer det innledende hastighetsbegrensende trinnet til RAAS ved å spalte av det N-terminale segmentet angiotensinogenå danne et biologisk inert dekapeptid angiotensin 1 eller Ang-(1-10). Den primære kilden til angiotensinogen er leveren. Den langsiktige økningen i blodangiotensinogennivåer som oppstår under graviditet, Cushings syndrom eller glukokortikoidbehandling kan forårsake hypertensjon, selv om det er bevis på at den kroniske økningen i plasmaangiotensinkonsentrasjon delvis oppveies av en reduksjon i reninsekresjon. Inaktivt dekapeptid Ang 1 hydrolyseres angiotensinkonverterende enzym (ACE), som spalter det C-terminale dipeptidet og dermed dannes oktapeptid Ang 2, biologisk aktiv, kraftig vasokonstriktor. ACE er en eksopeptidase og skilles hovedsakelig ut av lunge- og nyreendotel, nevroepitelceller. Den enzymatiske aktiviteten til ACE er å øke vasokonstriksjon og redusere vasodilatasjon.
Nye data om komponentene i renin-angiotensin-systemet
Selv om Ang2 er det mest biologisk aktive produktet av RAAS, er det bevis på at andre metabolitter av angiotensin 1 og 2 også kan ha betydelig aktivitet. Angiotensin 3 og 4 (Ang 3 og Ang 4) dannes ved aminosyrespaltning fra N-terminalen av Angiotensin 2 på grunn av virkningen av aminopeptidasene A og N. Ang 3 og 4 produseres oftest i vev med høyt innhold av disse enzymene, som hjernen og nyrene. Ang 3, et heptapeptid dannet ved aminosyrespaltning fra N-terminalen, finnes oftest i sentralnervesystemet, hvor Ang III spiller en viktig rolle i å opprettholde blodtrykket. Ang IV heksapeptidet er resultatet av ytterligere enzymatisk spaltning av AngIII. Ang 2 og 4 er ment å samarbeide. Et eksempel er økningen i cerebralt blodtrykk forårsaket av virkningen av disse angiotensinene på AT1-reseptoren. Dessuten krever denne hemodynamiske effekten av Ang 4 tilstedeværelsen av både Ang2 og selve AT1-reseptoren. Peptider oppnådd ved spaltning av aminosyrer fra C-terminalen kan også ha biologisk aktivitet. For eksempel kan Ang-(1-7), et heptapeptidfragment av angiotensin 2, dannes fra både Ang2 og Ang1 ved virkningen av en rekke endopeptidaser, eller ved virkningen av karboksypeptidaser (f.eks. en ACE-homolog kalt ACE2) spesielt på Ang2. I motsetning til ACE, kan ikke ACE2 delta i omdannelsen av Ang1 til Ang2, og aktiviteten undertrykkes ikke av ACE-hemmere (ACEI). Ang-(1-7), som fungerer gjennom spesifikke reseptorer, ble først beskrevet som en vasodilator og som en naturlig hemmer av ACEI. Det er også kreditert med kardiobeskyttende egenskaper. ACE2 kan også spalte én aminosyre fra C-terminalen, noe som resulterer i Ang-(1-9), et peptid med ukjente funksjoner.
Angiotensin II-reseptorer
Minst 4 angiotensinreseptorsubtyper er beskrevet.
- Den første typen AT1-R er involvert i implementeringen av det største antallet etablerte fysiologiske og patofysiologiske funksjoner av angiotensin 2. Effekter på det kardiovaskulære systemet (vasokonstriksjon, økt blodtrykk, økt hjertekontraktilitet, vaskulær og hjertehypertensjon), effekter på nyrene (Na + reabsorpsjon, hemming av utskillelse renin), sympatisk nervesystem, binyrene (stimulering av aldosteronsyntese). AT1-R-reseptoren medierer også effekten av angiotensin på cellevekst, spredning, inflammatoriske responser og oksidativt stress. Denne reseptoren er G-proteinkoblet og inneholder syv membranintegrerte sekvenser. AT1-R er mye til stede i mange Ang 2 målcelletyper.
- Den andre typen AT2-R er bredt representert i perioden med embryonal utvikling av hjernen, nyrene, og deretter, i perioden med postnatal utvikling, reduseres mengden av denne reseptoren. Det er bevis på at til tross for det lave uttrykksnivået i den voksne kroppen, kan AT2-reseptoren fungere som en mediator i prosessen med vasodilatasjon og også ha antiproliferative og antiapoptotiske effekter i vaskulær glatt muskulatur og hemme veksten av kardiomyocytter. I nyrene forventes AT2-aktivering å påvirke reabsorpsjon i den proksimale viklede tubuli og stimulere omdannelsen av prostaglandin E2 til prostaglandin F2α.2,7. Men betydningen av noen av disse At2-relaterte aktivitetene er fortsatt uutforsket.
- Funksjonene til den tredje typen (AT3) reseptorer er ikke fullt ut forstått.
- Den fjerde typen reseptor (AT4) er involvert i frigjøringen av en plasminogenaktivatorhemmer (under virkningen av angiotensin 2, samt 3 og 4). Det antas at effektene som er karakteristiske for Ang 1-7, inkludert vasodilatasjon, natriurese, redusert proliferasjon og beskyttelse av hjertet, formidles gjennom unike reseptorer som ikke binder seg til Ang 2, slik som MAS-reseptorer.
Det bør også bemerkes at nyere data indikerer eksistensen av overflatereseptorer med høy affinitet som binder både renin og prorenin. De finnes i vevet i hjernen, hjertet, morkaken og nyrene (i glatt endotelmuskel og mesangium). Effektene av slike reseptorer er rettet mot en lokal økning i produksjonen av Ang2 og aktivering av ekstracellulære kinaser, slik som MAP-kinaser, som inkluderer ERK1 og ERK2. Disse dataene kaster lys over Ang2-uavhengige mekanismer for cellevekst aktivert av renin og prorenin.
Påvirkning på andre sekreter
Som nevnt tidligere, stimulerer Ang2, gjennom AT1-reseptorer, produksjonen av aldosteron i den glomerulære sonen i binyrene. Aldosteron er den viktigste regulatoren av K+-Na+ balanse og spiller dermed en viktig rolle i væskevolumkontroll. Det øker reabsorpsjonen av natrium og vann i de distale sammenviklede tubuli og samlekanaler (så vel som i tykktarmen og spytt- og svettekjertlene) og forårsaker dermed utskillelse av kalium- og hydrogenioner. Angiotensin 2, sammen med det ekstracellulære nivået av kaliumioner, er de viktigste regulatorene av aldosteron, men Ang2-syntese kan også være forårsaket av ACTH, noradrenalin, endotelin, serotonin og hemmet av ANP og NO. Det er også viktig å merke seg at Ang 2 er en viktig faktor i trofismen til binyrens glomerulære sone, som uten tilstedeværelse kan atrofiere.
Renin
- et enzym syntetisert av juxtaglomerulære celler i de renale afferente arteriolene, med en MM på ca. 40 kDa. Spesielt intensiv renindannelse oppstår under nyreiskemi. Lokaliseringen av juxtaglomerulære celler gjør dem spesielt følsomme for endringer i blodtrykket, samt konsentrasjonen av Na + og K + -ioner i væsken som strømmer gjennom nyretubuli. På grunn av disse egenskapene stimulerer enhver kombinasjon av faktorer som forårsaker en reduksjon i væskevolum (dehydrering, blodtrykksfall, blodtap, etc.) eller en reduksjon i NaCl-konsentrasjon frigjøringen av renin.
Samtidig virker de fleste regulatorer av reninsyntese gjennom nyrebaroreseptorer. Frigjøringen av renin påvirkes av tilstanden til sentralnervesystemet, samt en endring i kroppens posisjon i rommet. Spesielt når man beveger seg fra liggende stilling til sittende eller stående stilling (klinostatisk test), øker reninsekresjonen. Denne refleksreaksjonen skyldes en økning i tonen i den sympatiske delen av det autonome nervesystemet, som overfører impulser til de b-adrenerge reseptorene til de juxtaglomerulære cellene.
Hovedsubstratet som renin virker på er angiotensinogen- et protein som er en del av a2-globulinfraksjonen og dannes av leveren. Under påvirkning av glukokortikoider og østrogener øker syntesen av angiotensinogen betydelig. Som et resultat av virkningen av renin omdannes angiotensinogen til dekapeptid angiotensinJEG. Denne forbindelsen har en ekstremt svak effekt og har ingen signifikant effekt på blodtrykksnivået.
i mellomtiden angiotensinJeg under påvirkning av den såkalte angiotensinkonverterende enzym (ACE) blir til en kraftig vasokonstriktorfaktor - angiotensinII. ESS(dipeptidkarboksypeptidase) er et integrert protein som hovedsakelig ligger på membranen til endotelceller, epitel, mononukleære celler, nerveender, celler i reproduktive organer osv. Den løselige formen av ACE finnes i nesten alle kroppsvæsker.
Det er vanlig å skille mellom to isoformer av ACE. Den første av dem fikk kodenavnet «somatic». Denne isoformen har en MM på 170 kDa og inkluderer homologe C- og N-domener. Den andre formen for ACE ("reproduktiv") finnes i sædvæske, har en MM på ca. 100 kDa og tilsvarer C-domenet til den første ACE-isoformen. Hvert av de 2 angitte domenene inneholder aminosyrerester som kan ta del i dannelsen av en binding med sinkatomet. Slike Zn 2+ strukturer er typiske for mange metalloproteinaser og er hovedsetene for enzyminteraksjon med både substratet og ACE-hemmere.
Det skal bemerkes at ACE ikke bare fører til dannelsen angiotensin II, men ødelegger også bradykinin - forbindelse som utvider blodårene. Derfor er en økning i blodtrykket under påvirkning av ACE assosiert med både dannelsen av angiotensin II og nedbrytningen av bradykinin (fig. 32).
En viktig rolle for virkningen av ACE spilles av den ioniske sammensetningen og spesielt innholdet av kloridioner. Så, ved en høy konsentrasjon av Cl - C-domene av ACE hydrolyserer både bradykinin og angiotensin-I raskere enn N-domenet. I ekstracellulære områder, hvor konsentrasjonen av kloridanioner er høy, er N-domenet hovedsakelig ansvarlig for omdannelsen av angiotensin-I. Imidlertid, intracellulært, hvor konsentrasjonen av Cl er lav, kan N-domenet delta i hydrolysen av andre peptidstoffer.
De siste årene har det blitt fastslått at ACE spiller en viktig rolle i hematopoiesis, fordi under dens påvirkning dannelsen av hematopoetisk peptid hemmer dannelsen av hematopoietiske celler i benmargen.
Rollen til ACE i kroppen ble identifisert hos mus som mangler ACE-genet. Hos slike dyr ble lavt blodtrykk, ulike vaskulære dysfunksjoner, nedsatt struktur og funksjon av nyrene og infertilitet hos hanner observert.
AngiotensinII
øker blodtrykket ved å forårsake arteriolekonstriksjon og er det mest potente vasoaktive midlet kjent. I tillegg hemmer det dannelsen og frigjøringen av renin av de juxtaglomerulære cellene i nyren ved hjelp av en tilbakemeldingsmekanisme, som til slutt skal gjenopprette normale blodtrykksnivåer. Under påvirkning angiotensinII produksjonen av hovedmineralkortikoiden øker kraftig - aldosteron. Selv om denne virkningen er direkte, påvirker ikke angiotensin II kortisolproduksjonen. Hovedformålet med aldosteron er å beholde Na + (ved å øke reabsorpsjonen i nyretubuli) og frigjøring av K + og H + (hovedsakelig gjennom nyrene). Disse reaksjonene utføres som følger.
Aldosteron
trenger fra den ekstracellulære væsken inn i cellens cytoplasma og der kombineres den med en spesifikk reseptor, hvoretter det resulterende komplekset (aldosteron + reseptor) trenger inn i kjernen. Aldosteron stimulerer også åpningen av Na + kanaler, på grunn av hvilke Na + ioner kommer inn i cellen gjennom den apikale membranen fra lumen av tubuli.
Økningen i sekresjonen av K + under påvirkning av aldosteron skyldes en økning i permeabiliteten til den apikale membranen i forhold til disse ionene, på grunn av hvilken K + kommer inn fra cellen inn i lumen av tubuli.
Retensjon av Na + i kroppen, som angiotensin II, bidrar til en økning i blodtrykket.
AngiotensinII i stand til å binde seg til spesifikke reseptorer på de glomerulære cellene i binyrene. Innholdet av disse reseptorene avhenger i stor grad av konsentrasjonen av K + ioner. Så hvis nivået av K + øker, øker antallet reseptorer for angiotensin II i de glomerulære cellene. Med en reduksjon i konsentrasjonen av K + -ioner noteres den motsatte effekten. Derfor spiller K + ioner en stor rolle i virkningen av angiotensin II på binyrene.
Nylig er det slått fast at angiotensinII i stand til å aktivere makrofager, og dermed øke blodplateaggregering og akselerere blodpropp. Samtidig slipper det aktivatorhemmer plasminogen-Jeg (IAP-1), som kan være ledsaget av depresjon av fibrinolyse. MEN ngiotensinII er en av faktorene som bidrar til utvikling av aterogenese, hemming av apoptose og økt oksidativt stress i vev, og provoserer derved blodplateaggregering og trombose.
AngiotensinII er i stand til å forbedre myokardfunksjonen, er involvert i biosyntesen av noradrenalin og andre fysiologisk aktive stoffer. Samtidig kan det fungere som en vekstfaktor, som fører til vaskulær og hjertehypertrofi.
Noen dyr og mennesker angiotensinII under påvirkning av et enzym aminopeptidaser omdannet til heptapeptid angiotensinIII. Hos mennesker er nivået av angiotensin II omtrent 4 ganger høyere enn nivået av angiotensin III. Begge disse forbindelsene påvirker blodtrykk og aldosteronproduksjon og brytes ned ganske raskt av enzymer. angiotensinase.
Ved alvorlig nyresykdom, ledsaget av deres iskemi, på grunn av økt dannelse og sekresjon av renin, er det en vedvarende økning i blodtrykket (nyrehypertensjon). Bruk av ACE-hemmere under disse tilstandene fører til en rask normalisering av blodtrykket.
Avslutningsvis bør det igjen understrekes at angiotensin-renino-aldosteron-systemet er nært knyttet til funksjonen til kallikrein-kinin-systemet, fordi dannelsen av angiotensin II og ødeleggelsen av bradykinin utføres under påvirkning av det samme. enzym - ACE.
