Роль гормона ангиотензина для работы сердечно-сосудистой системы неоднозначна и во многом зависит от рецепторов, с которыми он взаимодействует. Наиболее известно его влияние на рецепторы первого типа, которые вызывают сужение сосудов, возрастание кровяного давления, способствуют синтезу гормона альдостерона, что влияет на количество солей в крови и объем циркулирующей крови.
Образование ангиотензина (ангиотонин, гипертензин) происходит путем сложных преобразований. Предшественником гормона является белок ангиотензиноген, большую часть которого вырабатывает печень. Белок этот относится к серпинам, большинство которых тормозят (ингибируют) ферменты, расщепляющие пептидную связь между аминокислотами в белках. Но в отличие от многих из них, ангиотензиноген на другие белки такого влияния не имеет.
Выработка белка повышается под воздействием гормонов надпочечников (прежде всего, кортикостероидов), эстрогенов, тиреоидных гормонов щитовидной железы, а также ангиотензина II, в который этот белок впоследствии преобразуется. Делает ангиотензиноген это не сразу: сначала под воздействием ренина, которые вырабатывают артериолы почечных клубочков в ответ на понижение внутрипочечного давления, ангиотензиноген трансформируется в первую, неактивную форму гормона.
Затем на него оказывает влияние ангиотензин превращающий фермент (АПФ), что образуется в лёгких и отщепляет от него две последние аминокислоты. В результате получается состоящий из восьми аминокислот активный октапептид, известный как ангиотонин II, который при взаимодействии с рецепторами оказывает влияние на сердечно-сосудистую, нервную системы, надпочечники и почки.
При этом гипертензин обладает не только сосудосуживающим действием и стимулирует выработку альдостерона, но и в больших количествах в одном из отделов головного мозга, гипоталамусе, повышает синтез вазопрессина, который влияет на выведение воды почками, способствует появлению чувства жажды.
Рецепторы гормона
В настоящий момент обнаружено несколько типов рецепторов ангиотонина II. Лучше всего изучены рецепторы подтипа АТ1 и АТ2. Большинство воздействий на организм как позитивных, так и негативных, происходит при взаимодействии гормона с рецепторами первого подтипа. Находятся они во многих тканях, больше всего – в гладких мышцах сердца, сосудов, в почках.
Влияют на сужение мелких артерий почечных клубочков, вызывая возрастание давления в них, способствуют реабсорбации (обратному всасыванию) натрия в почечных канальцах. От них во многом зависит синтез вазопрессина, альдостерона, эндотелина-1, работа адреналина и норадреналина, они же принимают участие в освобождение ренина.
К негативным воздействиям относят:
- угнетение апоптоза – апоптозом называют регулируемый процесс, во время которого организм избавляется от ненужных или поврежденных клеток, в том числе от злокачественных. Ангиотонин при влиянии на рецепторы первого типа способен притормозить их распад в клетках аорты и коронарных сосудов;
- увеличение количества «плохого холестерина», который способен спровоцировать атеросклероз;
- стимуляция разрастания гладкомышечных стенок сосудов;
- увеличение риска образования тромбов, которые замедляют ток крови по сосудам;
- гиперплазия интимы – утолщение внутренней оболочки кровеносных сосудов;
- активизация процессов ремоделирования сердца и сосудов, которая выражается в способности органа изменять свою структуру из-за патологических процессов, является одним из факторов артериальной гипертензии.

 Так, при слишком активной деятельности ренин-ангиотензиновой системы, которая регулирует давление и объем крови в организме, рецепторы АТ1 оказывают прямое и косвенное воздействие на повышение артериального давления. Также они негативно влияют на сердечно-сосудистую систему, вызывая утолщение стенок артерий, увеличение миокарда и другие недуги.
Так, при слишком активной деятельности ренин-ангиотензиновой системы, которая регулирует давление и объем крови в организме, рецепторы АТ1 оказывают прямое и косвенное воздействие на повышение артериального давления. Также они негативно влияют на сердечно-сосудистую систему, вызывая утолщение стенок артерий, увеличение миокарда и другие недуги.
Рецепторы второго подтипа также распространены по всему организму, больше всего находятся в клетках плода, после рождения их количество начинает уменьшаться. Некоторые исследования позволили предположить, что они оказывают существенное влияние на развитие и рост клеток эмбриона, формируют исследовательское поведение.
Доказано, что число рецепторов второго подтипа может возрастать при повреждении сосудов и других тканей, сердечной недостаточности, инфаркте. Это позволило выдвинуть предположение, что АТ2 участвуют в регенерации клеток и, в отличие от АТ1, способствуют апоптозу (гибели поврежденных клеток).
Исходя из этого, исследователи выдвинули предположение, что эффекты, которые оказывает ангиотонин через рецепторы второго подтипа, прямо противоположны его воздействию на организм через АТ1-рецепторы. В результате стимуляции АТ2 происходит вазодилатация (расширение просвета артерий и других кровеносных сосудов), тормозится увеличение мышечных стенок сердца. Воздействие этих рецепторов на организм находится лишь на стадии изучения, поэтому их влияние мало изучено.


Также почти неизвестна реакция организма на рецепторы третьего типа, которые были обнаружены на стенках нейронов, а также на АТ4, что расположены на эндотелиальных клетках, и отвечают за расширение и восстановление сети кровеносных сосудов, рост тканей и заживление при повреждениях. Также рецепторы четвертого подвида были найдены на стенках нейронов, и согласно предположениям отвечают за познавательные функции.
Разработки ученых в медикаментозной сфере
В результате многолетних исследований ренин-ангиотензиновой системы было создано немало лекарств, действие которых направлено на целенаправленное воздействие на отдельные части этой системы. Особое внимание ученые уделили негативному воздействию на организм рецепторов первого подтипа, что оказывают большое влияние на развитие сердечно-сосудистых осложнений, и поставили задачу разработать лекарства, направленные на блокирование этих рецепторов. Поскольку стало очевидно, что таким образом можно лечить артериальную гипертонию и предупредить сердечно-сосудистые осложнения.
В ходе разработок стало очевидно, что блокаторы рецепторов ангиотензина более эффективны, чем ингибиторы ангиотензин превращающего фермента, поскольку действуют сразу в нескольких направлениях и способны просачиваться сквозь гематоэнцефалический барьер.
Он разделяет центрально-нервную и кровеносную системы, защищая нервную ткань от находящихся в крови патогенов, токсинов, а также клеток иммунной системы, что из-за сбоев идентифицируют мозг как инородную ткань. Также он является барьером для некоторых лекарств, направленных на терапию нервной системы (зато пропускает питательные и биоактивные элементы).
Блокаторы рецепторов ангиотензина, проникнув сквозь барьер, притормаживают медиаторные процессы, что происходят в симпатической нервной системе. В результате угнетается высвобождение норадреналина и уменьшается стимуляция адреналиновых рецепторов, что находятся в гладких мышцах сосудов. Это приводит к возрастанию просвета кровеносных сосудов.
При этом каждый препарат обладает своими особенностями, например, такое влияние на организм особенно сильно выражено у эпроссартана, тогда как воздействие других блокаторов на симпатическую нервную систему противоречивы.

 Таким методом лекарства блокируют развитие эффектов, которые гормон оказывает на организм через рецепторы первого подтипа, предупреждая негативное воздействие ангиотонина на сосудистый тонус, способствуя обратному развитию гипертрофии левого желудочка и уменьшая слишком высокое артериальное давление. Регулярный продолжительный прием ингибиторов вызывает снижение гипертрофии кардиомиоцитов, разрастания гладкомышечных клеток сосудов, мезангиальных клеток и т.д.
Таким методом лекарства блокируют развитие эффектов, которые гормон оказывает на организм через рецепторы первого подтипа, предупреждая негативное воздействие ангиотонина на сосудистый тонус, способствуя обратному развитию гипертрофии левого желудочка и уменьшая слишком высокое артериальное давление. Регулярный продолжительный прием ингибиторов вызывает снижение гипертрофии кардиомиоцитов, разрастания гладкомышечных клеток сосудов, мезангиальных клеток и т.д.
Также необходимо заметить, что все антагонисты рецепторов ангиотензина характеризуются избирательным действием, которое направленно именно на то, чтобы блокировать рецепторы первого подтипа: на них они воздействуют в тысячи раз сильнее, чем на АТ2. Причем разница во влиянии для лозартана превышает тысячу раз, валсартана – двадцать тысяч раз.
При повышенной концентрации ангиотензина, что сопровождается блокадой АТ1-рецепторов, начинают проявляться защитные свойства гормона. Выражаются они в стимуляции рецепторов второго подтипа, что приводит к увеличению просвета кровеносных сосудов, замедление разрастания клеток и др.
Также при повышенном количестве ангиотензинов первого и второго типа образуется ангиотонин-(1-7), который также обладает сосудорасширяющим и натрийуретическим действиями. На организм он влияет через неидентифицированные АТх рецепторы.
Виды лекарств
Антагонисты рецепторов ангиотензина принято делить по химическому составу, фармакологическим характеристикам, способу связывания с рецепторами. Если говорить о химической структуре, ингибиторы принято делить на следующие виды:
- бифениловые производные тетразола (лозартан);
- бифениловые нететразоловые соединения (телмисартан);
- небифениловые нететразоловые соединения (эпросартан).
Что касается фармакологической активности, то ингибиторы могут являть собой активные лекарственные формы, которые характеризуются фармакологической активностью (валсартан). Или же быть пролекарствами, которые активизируются после преобразования в печени (кандесартана цилексетил). Некоторые ингибиторы содержат активные метаболиты (продукты обмена веществ), присутствие которых характеризуется более сильным и длительным воздействием на организм.


По механизму связывания препараты делят на такие, что обратимо связываются с рецепторами (лозартан, эпросартан), то есть при определенных ситуациях, например, когда происходит возрастание количества ангитензина в ответ на снижение циркулирующей крови, ингибиторы могут быть вытесненными из мест связывания. Есть и такие лекарства, что связываются с рецепторами необратимо.
Особенности приема препаратов
Больному назначают прием ингибиторов рецепторов ангиотензина при наличии артериальной гипертензии как при слабой, так и тяжелой форме недуга. Повысить эффективность блокаторов способно их сочетание с тиазидными диуретиками, поэтому уже разработаны препараты, что содержат в себе комбинацию этих лекарств.
Антогонисты рецепторов не являются препаратами быстрого действия, на организм они воздействуют плавно, постепенно, эффект держится около суток. При регулярной терапии выраженный лечебный эффект можно увидеть через две, и даже шесть недель после начала терапии. Принимать их можно вне зависимости от приема пищи, для эффективного лечения достаточно раз в день.
Препараты хорошо воздействуют на больных вне зависимости от пола и возраста, в т. ч. и на пожилых пациентов. Организм хорошо переносит все виды этих лекарств, что дает возможность использовать их для лечения больных с уже обнаруженной сердечно-сосудистой патологией.
Блокаторы рецепторов АТ1 имеют противопоказания и предостережения. Они запрещены людям с индивидуальной непереносимостью компонентов лекарства, беременным женщинам и в период лактации: они могут вызвать патологические изменения в организме малыша, результатом чего является его смерть в утробе матери или после рождения (это было установлено в ходе экспериментов над животными). Также не рекомендуют применять эти лекарства для лечения детей: насколько препараты для них безопасны, на сегодняшний день не определено.
С осторожностью врачи назначают ингибиторы людям, которые имеют пониженный объем циркулирующей крови, или анализы показали пониженное количество натрия в крови. Это обычно бывает при терапии диуретиками, если человек находится на бессолевой диете, при диарее. С оглядкой нужно применять препарат при аортальном или митральном стенозе, обструктивной гипертрофической кардиомиопатии.
Нежелателен прием лекарства людям, что находятся на гемодиализе (метод внепочечного очищения крови при почечной недостаточности). Если лечение назначают на фоне почечного заболевания, необходим постоянный контроль концентрации калия и крептинина сыворотки. Неэффективен препарат, если анализы показали повышенное количество альдостерона в крови.
Для цитирования:
Сидоренко Б.А., Преображенский Д.В., Заикина Н.В. ФАРМАКОТЕРАПИЯ ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНИ. Часть VI. Блокаторы ангиотензиновых рецепторов I типа как антигипертензивные препараты // РМЖ. 1998. №24. С. 4
Рассмотрены физиология ренин-ангиотензиновой системы и роль ее повышенной активности в патогенезе гипертонической болезни. Представлена сравнительная характеристика блокаторов ангиотензиновых рецепторов I типа.
The paper considers the physiology of the renin-angiotensin system and the role of its increased activity in the pathogenesis of essential hypertension. It comparatively characterizes antihypertensive angiotensin I receptor antagonists.
Б.А. Сидоренко, Д.В. Преображенский,
Н.В. Заикина - Медицинский центр Управления делами Президента Российской Федерации, Москва
V. A. Sidorenko, D. V. Preobrazhensky,
N. V. Zaikina - Medical Center, Administration of Affairs of the President of the Russian Federation, Moscow
Часть VI. Блокаторы ангиотензиновых рецепторов I типа как антигипертензивные препараты
Повышенная активность ренин-ангиотензиновой системы (РАС) в кровяном русле и тканях, как известно, является важным фактором патогенеза гипертонической болезни (ГБ) и некоторых вторичных форм артериальной гипертензии. Высокая активность ренина в плазме крови, отражающая гиперактивность РАС, является прогностически неблагоприятным показателем при ГБ. Так, у больных ГБ с высокой активностью ренина в плазме риск развития инфаркта миокарда в 3,8 раза выше, чем у больных с низкой активностью ренина. Высокая активность ренина в плазме крови сочетается с увеличением вероятности развития сердечно-сосудистых осложнений в 2,4 раза и смертности от всех причин - в 2,8 раза . До недавнего времени для подавления чрезмерной активности РАС у больных ГБ использовались симпатолитические средства центрального действия (резерпин), агонисты центральных a 2 -адренорецепторов (метилдопа, клонидин), b -адреноблокаторы (пропранолол, атенолол, метопролол и др.) и ингибиторы ангиотензинпревращающего фермента (АПФ). В 90-е годы появилась новая группа высокоэффективных антигипертензивных препаратов, действие которых основано на торможении активности РАС на уровне ангиотензиновых рецепторов I типа (АТ 1 -рецепторов) для ангиотензина II. Эти препараты получили название блокаторы АТ 1 -рецепторов, или антагонисты рецепторов для ангиотензина II.
Физиология ренин-ангиотензиновой системы
Для лучшего понимания механизмов антигипертензивного действия блокаторов АТ 1 -рецепторов необходимо остановиться на молекулярных и функциональных аспектах РАС.
Главным эффекторным пептидом РАС является ангиотензин II, который образуется из неактивного ангиотензина I под действием АПФ и некоторых других сериновых протеаз. Действие ангиотензина II на клеточном уровне опосредуется двумя типами мембранных рецепторов - АТ
1 и АТ 2 . Почти все известные физиологические (сердечно-сосудистые и нейроэндокринные) эффекты ангиотензина II опосредуются АТ
1 -рецепторами. Например, при ГБ имеют важное значение такие опосредуемые АТ
1 -рецепторами эффекты ангиотензина II, как артериальная вазоконстрикция и секреция альдостерона, а также стимуляция пролиферации кардиомиоцитов и гладкомышечных клеток сосудистой стенки. Все эти эффекты ангиотензина II, как полагают, способствуют повышению артериального давления (АД), развитию гипертрофии левого желудочка и утолщению стенок артерий, которое сопровождается уменьшением их просвета, у больных ГБ.
Таблица 1. Физиологические эффекты ангиотензина II, которые опосредуются АТ1- и АТ2-рецепторами (по C. Johnston и J. Risvanis)
| АТ 1 -рецепторы | АТ 2 -рецепторы |
| Вазоконстрикция | Стимуляция апоптоза |
| Стимуляция синтеза и секреции альдостерона | Антипролиферативный эффект |
| Реабсорбция натрия в почечных канальцах | Дифференцировка и развитие эмбриональных тканей |
| Гипертрофия кардиомиоцитов | Рост эндотелиальных клеток |
| Пролиферация гладкомышечных клеток сосудистой стенки | Вазодилатация |
| Усиление периферической норадреналинергической активности | |
| Усиление активности центрального звена симпатической | |
| нервной системы | |
| Стимуляция высвобождения вазопрессина | |
| Снижение почечного кровотока | |
| Торможение секреции ренина |
Эффекты ангиотензина II, опосредуемые АТ 2 -рецепторами, стали известны лишь в последние годы. При ГБ наиболее важное значение имеют те физиологические эффекты ангиотензина II (а также ангиотензина III), которые опосредуются АТ
2 -рецепторами, а именно вазодилатация и торможение пролиферации клеток, в том числе кардиомиоцитов, фибробластов и гладкомышечных клеток сосудистой стенки (табл. 1). Как можно видеть, при стимуляции АТ
2 -рецепторов ангиотензин II частично ослабляет свои собственные эффекты, связанные со стимуляцией АТ
1 -рецепторов.
Схема 1. Пути образования двух основных эффекторных пептидов РАС - ангиотензина II и ангиотензина-(I-7). Ангиотензин II в дальнейшем превращается в ангиотензин III и ангиотензин IV, обладающие некоторой биологической активностью, которая опосредуется соответственно АТ 3 - и АТ 4 -рецепторами (на схеме не обозначены).
АТ 1 -рецепторы на мембранах гепатоцитов и клеток юкстагломерулярного аппарата (ЮГА) почек опосредуют механизмы отрицательной обратной связи в РАС. Поэтому в условиях блокады АТ
1 -рецепторов в результате нарушений этих механизмов отрицательной обратной связи увеличиваются синтез ангиотензиногена в печени и секреция ренина клетками ЮГА почек. Иными словами, при блокаде АТ
1 -рецепторов происходит реактивная активация РАС, которая проявляется повышением уровня ангиотензиногена, ренина, а также ангиотензина I и ангиотензина II.
Повышенное образование ангиотензина II в условиях блокады АТ
1 -рецепторов приводит к тому, что начинают преобладать эффекты ангиотензина II, опосредуемые АТ 2 -рецепторами. Следовательно, последствия блокады АТ
1 -рецепторов двоякие. Прямые последствия связаны с ослаблением фармакологических эффектов, опосредуемых АТ 1 -рецепторами. Косвенные последствия являются результатом стимуляции АТ
2 -рецепторов ангиотензином II, который в условиях блокады АТ
1 -рецепторов образуется в повышенном количестве.
Третий механизм антигипертензивного действия блокаторов АТ
1 -рецепторов объясняется повышенным образованием в условиях блокады АТ
1 -рецепторов другого эффекторного пептида РАС - ангиотензина-(I-7), обладающего вазодилатирующими свойствами. Ангиотензин-(I-7) образуется из ангиотензина I под действием нейтральной эндопептидазы и из ангиотензина II под действием пролиловой эндопептидазы. В условиях блокады АТ
1 -рецепторов повышенный уровень ангиотензина I и ангиотензина II в крови предрасполагает к усиленному превращению их в ангиотензин-(I-7) .
Ангиотензин-(I-7) обладает вазодилатирующим действием и натрийуретическими свойствами, которые опосредуются простагландинами I2, кининами и оксидом азота. Эти эффекты ангиотензина-(I-7) обусловлены его действием на неидентифицированные пока АТ-рецепторы - АТх-рецепторы (схема 1).
Таким образом, механизмов антигипертензивного действия у блокаторов АТ
1 -рецепторов три - один прямой и два косвенных. Прямой механизм связан с ослаблением эффектов ангиотензина II, которые опосредуются АТ
1 -рецепторами. Косвенные механизмы связаны с реактивной активацией РАС в условиях блокады АТ
1 -рецепторов, которая ведет к повышенному образованию как ангиотензина II, так и ангиотензина-(I-7). Ангиотензин II оказывает антигипертензивное действие, стимулируя незаблокированные АТ
2 -рецепторы, в то время как ангиотензин-(I-7) оказывает антигипертензивное действие, стимулируя АТх-рецепторы (схема 2).
Клиническая фармакология блокаторов АТ 1 -рецепторов
Существуют два основных типа АТ-рецепторов - АТ 1 и АТ
2 . Соответственно различают селективные блокаторы АТ
1 - и АТ
2 -рецепторов. В клинической практике используются блокаторы АТ
1 -рецепторов, которые оказывают антигипертензивное действие. В настоящее время применяются или проходят клинические испытания по меньшей мере восемь непептидных селективных блокаторов АТ
1 -рецепторов: вальзартан, золарзартан, ирбезартан, кандезартан, лозартан, тазозартан, тельмизартан и эпрозартан.
По химической структуре непептидные блокаторы АТ
1 -рецепторов можно разделить на три основные группы:
. бифениловые производные тетразола - лозартан, ирбезартан, кандезартан и др.;
. небифениловые производные тетразола - эпрозартан и др.;
. негетероциклические соединения - вальзартан и др. .
Некоторые блокаторы АТ
1 -рецепторов сами по себе обладают фармакологической активностью (вальзартан, ирбезартан), другие (например, кандезартана цилексетил) становятся активными лишь после ряда метаболических превращений в печени. Наконец, у таких активных АТ
1 -блокаторов, как лозартан и тазозартан, есть активные метаболиты, оказывающие более сильное и длительное действие, чем сами препараты. Следовательно, блокаторы АТ
1 -рецепторы можно разделить на активные препараты и пролекарственные формы АТ
1 -блокаторов.
По механизму связывания с АТ
1 -рецепторами доступные АТ
1 -блокаторы разделяются на конкурентные и неконкурентные антагонисты ангиотензина II. К конкурентным АТ 1 -блокаторам относятся вальзартан, ирбезартан и лозартан, к неконкурентным - активная форма кандезартана цилексетила (кандезартан) и активный метаболит лозартана (Е-3174).
Продолжительность антигипертензивного действия блокаторов АТ
1 -рецепторов определяется как прочностью их связи с АТ
1 -рецепторами, так и периодом полужизни препаратов или их активных лекарственных форм и активных метаболитов (табл. 2).
Наряду с блокаторами АТ 1 -рецепторов существуют селективные блокаторы АТ
2 -рецепторов - CGP 42112 и PD 123319. В отличие от АТ
1 -блокаторов блокаторы АТ
2 -рецепторов не оказывают антигипертензивного действия и пока не используются в клинической практике.
Лозартан
- первый непептидный блокатор АТ 1 -рецепторов, который успешно прошел клинические испытания и разрешен к использованию для лечения ГБ и хронической сердечной недостаточности.
После приема внутрь лозартан всасывается в желудочно-кишечном тракте; концентрация препарата в плазме крови достигает максимума в течение 30 - 60 мин. При первом прохождении через печень лозартан в значительной степени метаболизируется, в результате чего его системная биодоступность составляет 19 - 62% (в среднем 33%). Период полужизни лозартана в плазме крови составляет 2,1 ± 0,5 ч. Тем не менее антигипертензивный эффект препарата сохраняется на протяжении 24 ч, что объясняется наличием у него активного метаболита - Е-3174, который в 10 - 40 раз сильнее блокирует АТ
1 -рецепторы, чем лозартан. Кроме того, у Е-3174 более длительный период полужизни в плазме крови - от 4 до 9 ч. Лозартан и Е-3174 выводятся из организма как через почки, так и через печень. Через почки выводится примерно 50% всего количества Е-3174.
Рекомендуемая доза лозартана при лечении артериальной гипертензии - 50 - 100 мг/сут в один прием .
Вальзартан
- высокоселективный блокатор АТ 1 -рецепторов. Он более селективен, чем лозартан. В то время как у лозартана сродство к АТ
1 -рецепторам в 10 000 раз выше, чем к АТ
2 -рецепторам, у вальзартана показатель АТ
1 -селективности составляет 20 000 - 30 000: 1. У вальзартана в отличие от лозартана нет активных метаболитов. Период его полужизни в плазме крови составляет около 5 - 7 ч и сопоставим с таковым активного метаболита лозартана Е-3174. Это объясняет, почему антигипертензивный эффект вальзартана сохраняется в течение 24 ч. Основной путь элиминации вальзартана - выведение с желчью и калом.
Больным ГБ вальзартан назначают в дозе 80 - 160 мг/сут в один прием .
Ирбезартан
- селективный блокатор АТ
1 -рецепторов. Как АТ
1 -блокатор он менее селективен, чем вальзартан. Показатель АТ
1 -селективности у ирбезартана такой же, как у лозартана - 10 000: 1. Ирбезартан в 10 раз сильнее связывается с АТ
1 -рецепторами, чем лозартан, и несколько сильнее, чем активный метаболит лозартана Е-3174.
Биодоступность ирбезартана составляет 60 - 80%, что значительно выше, чем у других блокаторов АТ
1 -рецепторов.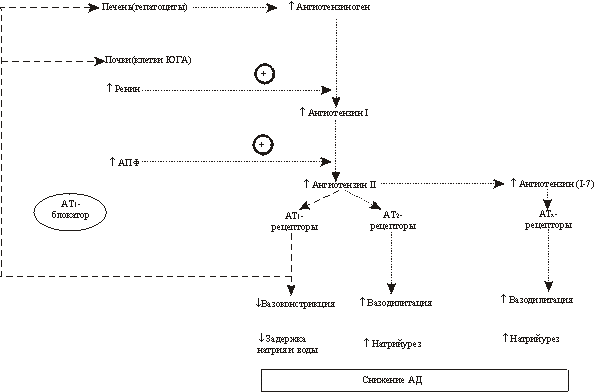
Схема 2. Прямые и косвенные последствия блокады АТ 1 -рецепторов. Снижение АД при лечении селективными блокаторами АТ 1 -рецепторов является следствием не только ослабления эффектов ангиотензина II, опосредуемых АТ 1 -рецепторами, но и усиления эффектов ангиотензина II, опосредуемых АТ 2 -рецепторами, и эффектов ангиотензина-(I-7), опосредуемых АТ х -рецепторами.
В отличие от лозартана и вальзартана биодоступность ирбезартана не зависит от совместного приема пищи. Период полужизни ирбезартана в плазме крови достигает 11 - 17 ч. Ирбезартан выводится из организма преимущественно с желчью и калом; с мочой выводится примерно 20% дозы препарата.
Для лечения ГБ ирбезартан назначают в дозе 75 - 300 мг/сут в один прием .
Кандезартана цилексетил
- пролекарственная форма АТ 1 -блокатора. После приема внутрь кандезартана цилексетила в крови не обнаруживается, поскольку быстро и полностью превращается в активное соединение - кандезартан (CV-11974). Сродство кандезартана к АТ
1 -рецепторам более чем в 10 000 раз выше, чем сродство к АТ
2 -рецепторам. Кандезартан в 80 раз сильнее связывается с АТ
1 -рецепторами, чем лозартан, и в 10 раз сильнее, чем активный метаболит лозартана Е-3174.
Кандезартан прочно связывается с АТ
1 -рецепторами, диссоциация его из связи с АТ 1 -рецепторами происходит медленно. Эти данные о кинетике связывания кандезартана с АТ
1 -рецепторами дают основание предполагать, что в отличие от лозартана кандезартан действует как неконкурентный антагонист ангиотензина II.
После приема кандезартана цилексетила максимальная концентрация его активной формы - кандезартана - в плазме крови обнаруживается через 3,5 - 6 ч. Период полужизни кандезартана в плазме крови колеблется от 7,7 до 12,9 ч, составляя в среднем 9 ч. Из организма кандезартан выводится через почки, а также с желчью и калом.
Средняя доза кандезартана цилексетила для лечения артериальной гипертензии - 8 - 16 мг/сут в один прием .
Эпрозартан
- селективный блокатор АТ 1 -рецепторов. По химической структуре он отличается от других АТ
1 -блокаторов тем, что является небифениловым производным тетразола. Эпрозартан обладает важным дополнительным свойством: он блокирует пресинаптические АТ
1 -рецепторы в симпатической нервной системе. Благодаря этому свойству эпрозартан (в отличие от вальзартана, ирбезартана и лозартана) тормозит высвобождение норадреналина из окончаний симпатических нервных волокон и тем самым уменьшает стимуляцию a1-адренорецепторов гладкой мускулатуры сосудов. Иными словами, у эпрозартана имеется дополнительный механизм вазодилатирующего действия. Кроме того, эпрозартан, и вальзартан в отличие от лозартана и ирбезартана не оказывают влияния на активность ферментов цитохромной Р-450 системы и не взаимодействует с другими лекарственными препаратами.
Таблица 2. Сравнительная характеристика основных блокаторов АТ1-рецепторов
| Препарат | Биодоступность, % | Активный метаболит |
Период полужизни, ч |
|
| препарата | активного метаболита | |||
| Вальзартан | 10 - 35 | Нет | 5 - 7 | - |
| Ирбезартан | 60 - 80 | Нет | 11 - 17 | - |
| Кандезартана цилексетил | ? | Кандезартан | 3,5 - 4 | 8 - 13 |
| Лозартан | 19 - 62 | Е-3174 | 1,5 - 2 | 4 - 9 |
| Эпрозартан | 13 | Нет | 5 - 9 | - |
Эпрозартан является активной формой блокатора АТ 1 -рецепторов. Его биодоступность при приеме внутрь составляет около 13%. Концентрация эпрозартана в плазме крови достигает максимума в течение 1 - 2 ч после приема препарата внутрь. Период полужизни эпрозартана в плазме крови составляет 5 - 9 ч. Эпрозартан выводится из организма в основном с желчью и калом в неизмененном виде; примерно 37% принятой внутрь дозы препарата экскретируется с мочой.
Для лечения артериальной гипертензии эпрозартан назначают в дозе 600 - 800 мг/сут в один или два приема .
Таблица 3. Основные сердечно-сосудистые и нейроэндокринные эффекты блокаторов АТ1-рецепторов
| . Сердечно-сосудистые (и почечные) эффекты:
Системная артериальная вазодилатация (снижение АД, уменьшение общего периферического сосудистого сопротивления и посленагрузки на левый желудочек);
Нейроэндокринные эффекты: Повышение уровня ангиотензина II, ангиотензина I и активности ренина в плазме; |
Фармакологические эффекты блокаторов АТ
1
-рецепторов
По механизму действия блокаторы АТ
1 -рецепторов во многом напоминают ингибиторы АПФ. Блокаторы АТ 1 -рецепторов и ингибиторы АПФ подавляют чрезмерную активность РАС, действуя на различные уровни этой системы. Поэтому фармакологические эффекты АТ
1 -блокаторов и ингибиторов АПФ в общем сходны, однако первые, будучи более избирательными ингибиторами РАС, значительно реже дают побочные эффекты.
Основные сердечно-сосудистые и нейроэндокринные эффекты блокаторов АТ
1 -рецепторов приведены в табл. 3.
Показания и противопоказания к назначению АТ
1 -блокаторов также во многом совпадают с таковыми для ингибиторов АПФ. Блокаторы АТ
1 -рецепторов предназначены для длительной терапии ГБ и хронической сердечной недостаточности. Перспективным, как полагают, может оказаться применение АТ
1 -блокаторов при лечении диабетической нефропатии и других поражений почек, включая реноваскулярную гипертензию.
Противопоказаниями
к назначению блокаторов АТ
1 -рецепторов считаются: индивидуальная непереносимость препарата, беременность, грудное вскармливание. Требуется большая осторожность при назначении блокаторов АТ
1 -рецепторов при стенозирующем поражении обеих почечных артерий или артерии единственной функционирующей почки.
Опыт применения блокаторов АТ 1 -рецепторов при лечении ГБ
В последние годы блокаторы АТ 1 -рецепторов находят все более широкое применение в качестве антигипертензивных средств. Это объясняется тем, что АТ
1 -блокаторы сочетают высокую антигипертензивную эффективность с превосходной переносимостью. Кроме того, блокаторы АТ
1 -рецепторов дают клинически значимый протективный эффект. Они способны вызывать обратное развитие гипертрофии левого желудочка и подавлять гипертрофию гладкой мускулатуры сосудистой стенки, уменьшают внутриклубочковую гипертензию и протеинурию. В сердце и почках АТ
1 -блокаторы ослабляют развитие фиброзных изменений.
В большинстве случаев блокаторы АТ
1 -рецепторов оказывают значительное и равномерное антигипертензивное действие, которое сохраняется до 24 ч. Поэтому все доступные АТ 1 -блокаторы рекомендуется принимать один раз в сутки. Если антигипертензивный эффект блокатора АТ
1 -рецепторов недостаточен, добавляют диуретик.
Лозартан был первым блокатором АТ
1 -рецепторов, который стал использоваться для лечения ГБ. По данным литературы , лозартан в дозе 50 - 100 мг/сут снижает систолическое АД в среднем на 10 - 20%, диастолическое - на 6 - 18%. Антигипертензивная эффективность лозартана сравнима с таковой эналаприла, атенолола и фелодипина-ретард и значительно превосходит эффективность каптоприла.
Опыт клинического изучения эффективности и безопасности лозартана почти у 3000 больных ГБ свидетельствует, что побочные эффекты при его применении встречаются с такой же частотой, как и при назначении плацебо (соответственно 15,3 и 15,5%).
В отличие от ингибиторов АПФ лозартан и другие АТ 1 -рецепторов не вызывают мучительного сухого кашля и ангионевротического отека. Поэтому АТ
1 -блокаторы, как правило, рекомендуют использовать для лечения артериальной гипертензии у больных с противопоказаниями к назначению ингибиторов АПФ.
Лозартан - единственный АТ
1 -блокатор, о котором известно, что он способен увеличивать продолжительность жизни больных с хронической сердечной недостаточностью в большей степени, чем ингибитор АПФ каптоприл . Учитывая данные о профилактической эффективности лозартана при хронической сердечной недостаточности, все блокаторы АТ
1 -рецепторов рекомендуется использовать в качестве антигипертензивных препаратов первого ряда для лечения артериальной гипертензии у больных с систолической дисфункцией левого желудочка.
Вальзартан назначают в дозе 80 - 160 мг/сут. В дозе 160 мг/сут вальзартан, по-видимому, более эффективен как антигипертензивный препарат, чем лозартан в дозе 1
00 мг/сут. Как и другие АТ
1 -блокаторы, вальзартан отличается превосходной переносимостью. Частота побочных эффектов при его длительном применении не отличается от таковой при назначении плацебо (соответственно 15,7 и 14,5%) .
Ирбезартан назначают в дозе 150 - 300 мг/сут. В дозе 300 мг/сут препарат более эффективен, чем лозартан в дозе 100 мг/сут. Частота побочных эффектов при лечении ирбезартаном и назначении плацебо одинакова .
Кандезартана цилексетил, по-видимому, самый сильный из доступных в
настоящее время блокаторов АТ 1 -рецепторов. Его назначают в дозе 4 - 16 мг/сут. В дозе 16 мг/сут кандезартан в значительно большей степени снижает АД, чем лозартан в дозе 50 мг/сут. Кандезартан, по-видимому, оказывает более продолжительное антигипертензивное действие, чем лозартан. Кандезартан превосходно переносится больными. Из-за развития побочных эффектов препарат пришлось отменить у 1,6 - 2,2% больных ГБ против 2,6% больных, получавших плацебо .
Эпрозартан назначают в дозе 600 и 800 мг/сут в
один прием. При тяжелой гипертензии эпрозартан и эналаприл в одинаковой степени снижали диастолическое АД (в среднем соответственно на 20,1 и 16,2 мм рт. ст.), однако эпрозартан вызывал достоверно большее снижение систолического АД, чем эналаприл (в среднем соответственно на 29,1 и 21,1 мм рт. ст.). Частота побочных эффектов при назначении эпрозартана такая же, как при приеме плацебо.
Таким образом, блокаторы АТ 1 -рецепторов представляют собой новый класс антигипертензивных препаратов. Антигипертензивная эффективность АТ
1 -блокаторов сопоставима с таковой ингибиторов АПФ при гораздо лучшей переносимости.
Литература:
1. Alderman MN, Ooi WL, Madhavan S, et al. Plasma renin activity: A risk factor for myocardial infection in hypertensive patients. Amer
J Hypertens 1997;10:1-8.
2. Johnston CI, Risvanis J. Preclinical pharmacology of angiotensin II receptor anta-
gonists. Amer J Hypertens 997;10:306S-310S.
3. Преображенский Д.В., Сидоренко Б.А., Соколова Ю.В., Носова И.К. Физиология и фармакология ренин-ангиотензиновой системы. Кардиология 1997;11:91-5.
4. Bauer JH, Reams GP. The angiotensin II type receptor antagonists. Arch Intern Med 1955;155:1361-8.
5. Сидоренко Б.А., Преображенский Д.В., Соколова Ю.В. Лозартан - первый представитель нового класса гипотензивных препаратов. Кардиология 1996;1:84-9.
6. Goa KL, Wagstaff A. Losartan potassium. A review of its pharmacology. Drugs 1996;51:820-45.
7. McIntyre M, Caffe SE, Machalar RA, Reid JL. Losartan, an orally active angiotensin (AT
1) receptor antagonist: A review of its efficacy and safety in essential hypertension. Pharmacol Ther 1997;74:181-94.
8. Markham A, Goa KL. Valsartan. A review of its pharmacology and therapeutic use in essential hypertension. Drugs 1997;54:299-311.
9. Brunner HR. The new angiotensin II receptor antagonist, irbesartan. Pharmacokinentec and pharmacodynamic considerations. Amer J Hypertens 1997;10:311S-317S.
10. Nishikawa K, Naka T, Chatani F, Ioshimure I. Candesartan cilexetil: A review of its preclinic
al pharmacology. J Hum Hypertens 1997;11(suppl 2):9-17.
11. Edwards RM, Aiyar N, Ohlstein EH, et al. Pharmacological characterization of non-peptide angiotensin II receptor antagonist, SK&F 108566. J Pharmacol Exp Ther 1992;260:175-81.
12. Сидоренко
Б.А., Носова И.К., Преображенский Д.В. Антагонисты АТ
1
-ангиотензиновых рецепторов - новая группа лекарственных препаратов для лечения артериальной гипертензии и хронической сердечной недостаточности. Клин. вестник 1997;4:26-8.
13. Pitt B, Segal R, Marti
nez FA, et al. Randomised trial of losartan versus captopril in patients over 65 with hert failure (Evaluation of Losartan in the Elderly study, ELITE). Lancet 1997;349:747-52.
14. Pool JL, Gutlirie RM, Littlejohn TW, et al. Dose-related antihypertensive effects of irbesartan in patients with mild-to-moderate hypertension. Amer J Hypertens 1998;11:462-70.
15. Andersson OK, Neldam S. The antihypertensive effect and tolerability of candesartan cilexetil, a new generation angiotensin II antagonist, in co
mparison with losartan. Blood Pressure 1998;7:53-9.
16. Belcher G, HЯbner R, George M, et al. Candesartan cilexetil: safety and tolerability in healthy volunteers and patients with hypertension. J Hum Hypertens 1997;11(suppl 2):85-9.
Для цитирования:
Кобалава Ж.Д., Шаварова Е.К. Антагонисты рецепторов ангиотензина II в кардиологической практике: современный взгляд на проблему // РМЖ. 2008. №11. С. 1609
Антагонисты рецепторов ангиотензина II (АРА II) - один из новых и наиболее динамично развивающихся классов антигипертензивных препаратов. Появив-шись в начале 90-х годов XX века, сартаны занимали второстепенные позиции. Считалось, что основной нишей для их применения является лечение пациентов, не переносящих прием ингибиторов ангиотензинпревращающего фермента (иАПФ) из-за появления кашля. С момента своего первого появления АРА II проделали сложный путь развития от новых лекарственных средств для лечения артериальной гипертонии (АГ), характеризующихся в первую очередь отличной переносимостью, до одного из основных классов кардиологических препаратов, доказавших свою превосходную эффективность в предотвращении сердечно-сосудистых осложнений у пациентов с АГ, сердечной недостаточностью, мерцательной аритмией, перенесших инфаркт миокарда, с патологией почек.
За сравнительно короткий срок было накоплено критическое количество важных экспериментальных и клинических данных, кардинально изменивших представление о сартанах. В настоящее время не вызывает сомнения, что благоприятное действие АРА II не ограничивается снижением артериального давления (АД) при АГ. Это позволило европейским экспертам обоснованно внести новые показания в современные рекомендации по лечению АГ, опубликованные в 2007 г. . Сартаны, наряду с ингибиторами АПФ, диуретиками, b-блока-торами, антагонистами кальция, равноправно могут являться как препаратом первого выбора, так и компонентом комбинированной терапии больного АГ. Новыми ситуациями относительно предыдущей версии рекомендаций, обосновывающими выбор в пользу АРА II по сравнению с другими классами антигипертензивных препаратов, являются инфаркт миокарда в анамнезе, сахарный диабет (наряду с иАПФ), пароксизмальная форма фибрилляции предсердий (наряду с иАПФ), метаболический синдром (наряду с иАПФ, антагонистами кальция) (табл. 1).
Кашель при приеме ингибиторов АПФ АРА II эффективно предотвращают вмешательство ренин-ангиотен-зин-альдостероновой системы (РААС) в сосудистые, тканевые и клеточные реакции. Сартаны - высокоселективные лекарственные соединения, избирательно блокирующие рецепторы 1 типа ангиотензина II и, по-ви-димому, способствующие стимуляции рецепторов ангиотензина II 2 типа. Блокада РААС, достигаемая при помощи сартанов, является максимально полной, поскольку предотвращает воздействие на специфические рецепторы ангиотензина II, продуцируемого не только по основному, но и по дополнительным путям. Селективное воздействие на рецепторы ангиотензина II 1 типа сочетается с сохранением метаболизма энкефалинов, брадикинина и других биологически активных пептидов, а именно с повышением активности кининовой системы на фоне лечения иАПФ связаны такие нежелательные эффекты, как сухой кашель и ангионевротический отек. Стимуляция рецепторов ангиотензина II 2 типа приводит к благоприятным антипролиферативным эффектам и вазодилатации.
Сартаны в лечении
артериальной гипертонии
Сартаны обладают уникальным профилем переносимости во всех применяемых дозовых режимах: при увеличении дозы не происходит увеличения частоты встречаемости побочных эффектов, что значительно повышает приверженность пациентов лечению. Отлич-ная переносимость сартанов, сравнимая с переносимостью приема плацебо, до последнего времени считалась главным достоинством этого класса препаратов, однако за последние годы накоплен достаточный материал, подтверждающий, что по эффективности АРА II ничуть не уступают основным классам антигипертензивных препаратов.
В 2008 г. был выполнен мета-анализ, посвященный оценке сравнительной эффективности иАПФ и АРА II в лечении АГ . Статистически проанализировав результаты 61 исследования, в том числе 47 рандомизированных контролируемых (РКИ), авторы пришли к выводу, что и АРА II, и иАПФ обладают сходной способностью снижать повышенное АД при длительном наблюдении у лиц, страдающих АГ. В 37 РКИ различий в динамике АД выявлено не было, в 8 РКИ большей антигипертензивной эффективностью обладали АРА II, в двух - иАПФ. Причем оба исследования, в которых первенствовали иАПФ, предполагали сравнение 50 мг лозартана с 20 мг эналаприла, в то время как при назначении 100 мг лозартана по сравнению с 10-20 мг эналаприла различий в степени снижения АД не наблюдалось. В анализируемых исследованиях при применении монотерапии иАПФ или АРА II удавалось достичь успеха в среднем у 55% пациентов. Под критериями успешности лечения подразумевали не только отсутствие потребности в назначении дополнительной терапии, но и адекватную приверженность пациента лечению на протяжении всего периода наблюдения. Поэтому, по мнению авторов, преимущества сартанов в первую очередь были связаны с лучшей переносимостью терапии, что особенно четко было продемонстрировано в ретроспективных когортных исследованиях, где частота отмены терапии была значительно выше в группе больных, леченных с применением иАПФ. Наиболее часто встречающимися побочными явлениями были головная боль, головокружение и кашель, причем при проведении мета-ана-лиза различий в частоте первых двух симптомов выявлено не было, в то время как кашель достоверно чаще выявлялся при терапии иАПФ по сравнению с АРА II (9,9% vs 3,2% - в РКИ, 1,7% vs 0,6% в когортных исследованиях, соответственно).
Авторы крупного мета-регрессионного анализа, посвященного оценке АД-зависимых и АД-незави-симых эффектов препаратов, блокирующих РААС, пришли к выводу, что ассоциированная со снижением АД способность АРА II и иАПФ положительно влиять на частоту коронарных событий одинакова . Небольшие дополнительные АД-независимые эффекты свойственны классу иАПФ.
Клинические исследования, в которых проводилось сравнение влияния АРА II и других антигипертензивных препаратов на заболеваемость и смертность при АГ, показали, что сартаны не только не уступают в антигипертензивной эффективности, но в некоторых ситуациях даже превосходят представителей традиционных классов кардиологических препаратов в способности влиять на прогноз.
В исследовании LIFE, в которое были включены более 9000 пациентов с АГ и ЭКГ-признаками гипертрофии левого желудочка, в группе терапии, начинавшейся с лозартана, в течение 5-летнего наблюдения было достигнуто сопоставимое с группой атенолола снижение АД. При этом лозартан оказался на 13% более эффективен в предупреждении сердечно-сосудистых событий (p=0,02), на 25% эффективнее предупреждая инсульты (p=0,02) и в одинаковой с атенололом степени предотвращал развитие инфарктов миокарда . При этом лозартан в большей степени по сравнению с атенололом способствовал регрессу гипертрофии левого желудочка.
Кандесартан достоверно лучше препятствовал развитию несмертельных инсультов у пожилых пациентов в исследовании SCOPE, в большей степени снижая АД по сравнению с плацебо и стандартной терапией .
Сравнение эффективности терапии на основе эпросартана и нитрендипина во вторичной профилактике инсульта проводилось в исследовании MOSES, в которое были включены 1352 пациента с АГ, перенесших острое нарушение мозгового кровоообращения. На протяжении всего периода (2,5 года) наблюдалось сопоставимое снижение САД и ДАД, также не зарегистрировано достоверных различий в частоте назначения комбинированной терапии. Эпросартан способствовал снижению риска развития цереброваскулярных осложнений на 25%. В группе эпросартана достигнуто преимущество по сравнению с группой больных, получавших нитрендипин, в отношении снижения общей смертности и частоты сердечно-сосудистых осложнений . Таким образом, можно говорить о доказанности кардио- и церебропротективных свойств АРА II.
Сравнение антигипертензивной мощности валсартана и амлодипина в исследовании VALUE оказалось в пользу антагониста кальциевых каналов, что сопровождалось достоверным снижением частоты инфарктов миокарда и тенденцией к снижению частоты инсультов в группе амлодипина . При этом достоверных различий по влиянию на общую смертность в этом исследовании получено не было.
Несмотря на одинаковый механизм действия препараты внутри одного и того же класса несколько отличаются друг от друга по фармакокинетическим свойствам и эффективности. В проспективном рандомизированном сравнительном исследовании COSIMA оценивалась антигипертензивная эффективность комбинированной терапии на основе диуретика и АРА II. Пациентам с АГ после 5-недельной монотерапии гидрохлортиазидом 12,5 мг назначались валсартан 80 мг или ирбесартан 150 мг. В группе ирбесартана через 8 не-дель лечения удалось в достоверно большем числе случаев добиться целевых значений АД (50,2% vs 33,2%, p=0,0003), различия в степени снижения систолического и диастолического АД также достоверно отличались в пользу ирбесартана . Дизайн этого исследования выбран не случайно. Около 2/3 пациентов, страдающих АГ, для достижения целевого уровня АГ нуждаются в комбинированной терапии. Согласно последним европейским рекомендациям по лечению АГ всем пациентам высокого и очень высокого риска комбинация двух антигипертензивных агентов должна быть назначена в качестве стартовой терапии . Обоснованными признаны комбинации сартанов с диуретиками или антагонистами кальция. В силу фармакокинетических характеристик повышение дозы до максимальной сартанов, также как и иАПФ, сопровождается умеренным приростом антигипертензивного эффекта, в то время как комбинация АРА II с низкими дозами диуретиков значительно потенциирует снижение АД . В частности, при сравнении эффективности ирбесартана и гидрохлортиазида (ГХТЗ) в монотерапии и их комбинаций в исследовании с дизайном по типу «матрица» 4 х 4 (фиксированные комбинации ирбесартана в дозе 0; 37,5; 100; 300 мг и ГХТЗ в дозе 0; 6,25; 12,5; 25 мг) продемонстрировано, что снижение диастолического АД при приеме плацебо составляет в среднем 3,5 мм рт.ст., ирбесартана - от 7,1 до 10,2 мм рт.ст., ГХТЗ - от 5,1 до 8,3 мм рт.ст., а в комбинации - от 8,1 до 15,0 мм рт.ст. . Кроме того, подобное сочетание позволяет нивелировать возможные побочные эффекты диуретиков (гипокалиемия, повышение уровня креатинина, мочевой кислоты, глюкозы), и сартанов (гиперкалиемия) .
Сартаны в терапии
хронической сердечной
недостаточности
Активация РААС считается одним из ключевых звеньев в патогенезе сердечной недостаточности (СН), способствуя развитию ремоделирования сердечно-со-судистой системы и прогрессированию заболевания. Вопрос о применении АРА II у больных с хронической СН довольно долго обсуждался в научных кругах. Пред-ставлялись возможными две стратегии применения АРА II при СН: совместно с иАПФ и вместо них.
Впервые возможность применения сартанов в качестве препарата для лечения хронической СН была подтверждена в исследованиях ELITE, ELITE-2. Терапия каптоприлом и лозартаном у больных с сердечной недостаточностью оказывала одинаковое влияние на смертность в исследовании ELITE-2 (10,4% vs 11,7%, соответственно) при на-блюдении в течение 555 дней . В то же время лозартан характеризовался значительно лучшей переносимостью по сравнению с каптоприлом. В группе сартана из-за нежелательных явлений были вынуждены прекратить лечение 9,7% пациентов, а в группе иАПФ - 14,7%. Сходные результаты получены в исследовании OPTIMAAL, в которое включали пациентов с сердечной недостаточностью, перенесших ин-фаркт миокарда: смертность в группе лозартана при наблюдении в течение 2,7 лет составила 18% и достоверно не отличалась от таковой в группе каптоприла - 16% . Эти же результаты подтвердило исследование VALIANT : у пациентов, перенесших инфаркт миокарда, осложнившимся систолической дисфункцией левого желудочка, сердечной недостаточностью, ни терапия валсартаном, ни терапия каптоприлом, ни комбинация двух препаратов не обладала преимуществами в отношении смертности и других клинических исходов. Таким образом, иАПФ и сартаны в одинаковой степени способны улучшать прогноз у пациентов с систолической дисфункцией левого желудочка.
От 30 до 50% пациентов с симптомами застойной сердечной недостаточности имеют нормальную или близкую к нормальной фракцию выброса - так называемую СН с сохранной фракцией выброса (ФВ), при этом смертность среди этих пациентов почти так же высока, как и у лиц с нарушением систолической функции . При диастолической СН размеры левого желудочка и ФВ остаются нормальными, но отмечается увеличение жесткости стенок и нарушение процессов релаксации, что приводит к снижению наполнения левого желудочка при нормальном давлении в левом предсердии . У пациента с изолированной диастолической СН, как правило, сердце справляется с функцией обеспечения метаболических потребностей организма, однако высокое конечно-диастолическое давление левого желудочка передается на сосуды малого круга, приводя к появлению застоя, одышки и других симптомов левожелудочковой СН . Препараты, блокирующие РААС, способствующие обратному ремоделированию сердечно-сосудистой системы, потенциально должны оказывать положительное влияние на прогноз у этой категории пациентов, но на сегодняшний день доказательная база по эффективности применения того или иного класса препаратов явно недостаточна.
Доказанная эффективность для больных с нарушенной систолической функцией не может быть экстраполирована на лиц, имеющих изолированное нарушение диастолической функции левого желудочка. Известно, что чаще СН с сохранной ФВ обнаруживается у пациентов более старшего возраста (>75 лет), у женщин вероятнее, чем у мужчин, характерен длительный анамнез АГ, ожирения, реже - указание на перенесенный инфаркт миокарда.
В скором времени будут опубликованы результаты исследования I-PRESERVE, которые позволят ответить на вопрос, может ли терапия ирбесартаном у больных с диастолической СН при сохранной систолической функции оказать дополнительные преимущества в отношении прогноза. Бесспорным достоинством данного спланированного исследования является выбор популяции пациентов . В исследование I-PRESERVE включены 4133 пациента, сходные по возрасту, полу, антропометрическим данным, средним значениям фракции выброса левого желудочка, выраженности клинических проявлений недостаточности кровообращения с реальной популяцией пациентов, страдающих СН с сохранной ФВ. Средний возраст пациентов - 72 года, 60% - женщины, средняя ФВ - 59%. У 64% пациентов причиной развития сердечной недостаточности является АГ, у небольшой доли пациентов в анамнезе имелись инфаркт миокарда (23%), коронарная реваскуляризация (13%), мерцательная аритмия (29%). Таким образом, выборка пациентов радикально отличается от выборки одной из ветвей исследования CHARM (CHARM-Preserved), в которой изучались преимущества применения кандесартана у больных СН с сохранной ФВ . К концу 36-месячного наблюдения в исследовании CHARM-Preserved было отмечено достоверное уменьшение количества госпитализаций по поводу СН, но абсолютных преимуществ сартанов в отношении снижения частоты инсультов, инфарктов, реваскуляризации миокарда не получено. Это может объясняться, с одной стороны, небольшой длительностью наблюдения, а с другой - особенностью критериев включения, благодаря которым в исследовании участвовали пациенты, отличающиеся от реальной популяции пациентов, страдающих СН с сохранной ФВ (средний возраст - 67 лет, всего 40% женщин, средняя ФВ - 54%, лишь 23% пациентов имели в качестве причины развития СН гипертоническую болезнь, более половины больных страдали ИБС).
До последнего времени оставался открытым вопрос о возможности совместного применения сартанов и иАПФ у больных высокого риска. Предполагалось, что сочетанное воздействие этих классов препаратов позволит более полно блокировать РААС, тем самым значительно улучшая прогноз. Окончательную точку в этой дискуссии поставили результаты недавно завершившегося исследования ONTARGET . Пациентам с артериальной гипертонией высокого риска, страдающим ИБС, атеросклерозом нижних конечностей, сахарным диабетом, перенесшим инфаркт миокарда, инсульт, назначалась терапия телмисартаном 80 мг или рамиприлом 10 мг или их комбинацией. Первичной комбинированной конечной точкой являлась смерть от сердечно-сосудистых причин, инфаркт миокарда, инсульт, госпитализации по поводу СН. В исследовании участвовали более 25 тысяч больных. К концу наблюдения (56 месяцев) различий в частоте развития первичной конечной точки выявлено не было (16,5% в группе рамиприла vs 16,7% в группе телмисартана, ОР 1,01, 95% ДИ 0,94-1,09). По сравнению с группой рамиприла в группе телмисартана реже встречались кашель (4,2% vs 1,1%, p<0,001) и ангионевротический отек (0,3% vs 0,1%, p=0,01), но чаще случаи гипотензии (1,7% vs 2,6%, p<0,001). Частота синкопальных состояний не отличалась между группами. Телмисартан и комбинация сартана с иАПФ в большей степени снижали АД по сравнению с рамиприлом, однако после поправки на это также не выявлено различий по частоте исходов. В группе комбинированной терапии частота первичных конечных точек составила 16,3%, однако достоверно чаще по сравнению с группой рамиприла регистрировались почечная дисфункция (13,5% vs 10,2%, p<0,001) и гипотензия (4,8% vs 1,7%, p<0,001). Таким образом, телмисартан доказал свою терапевтическую эквивалентность рамиприлу у пациентов с распространенным сосудистым поражением и у больных сахарным диабетом высокого риска при лучшей переносимости, что служит еще одним доказательством сопоставимости класса сартанов по сравнению с классом иАПФ. Комби-нированная терапия с использованием и сартана, и иАПФ сопровождалась увеличением частоты встречаемости побочных эффектов по сравнению с терапией рамиприлом, не оказывая дополнительного положительного влияния на прогноз больного (рис. 1)
Сартаны в лечении
фибрилляции предсердий
При длительном лечении пациента с мерцательной аритмией выбор стратегии контроля ритма не оказывает влияния на долгосрочный прогноз, хотя и улучшает качество жизни пациентов, уменьшая выраженность симптомов . Антиаритмическая терапия зачастую характеризуется плохой переносимостью, радиочастотные методы лечения доступны ограниченному кругу больных, поэтому поиск безопасных фармакологических средств, способных влиять на течение мерцательной аритмии и прогноз пациентов, продолжаются. В спектр этих препаратов входят и сартаны. Доказано повышение тканевого уровня ангиотензинпревращающего фермента и увеличение экспрессии рецепторов к ангиотензину у пациентов с фибрилляцией предсердий . Активация РААС широко вовлечена в прогрессирование хронической СН и может способствовать возникновению фибрилляции предсердий. Ангиотензин II, вызывая пролиферацию фибробластов и снижая активность коллагеназ, является мощным активатором процессов фиброза миокарда . Блокада РААС, вызываемая АРА II или иАПФ, приводит к замедлению процессов фиброза предсердий, снижению давления в левом предсердии, уменьшению эктопической активности предсердий . Кроме того, определенную роль в профилактике фибрилляции предсердий может играть непосредственный гемодинамический эффект препаратов за счет снижения постнагрузки.
При анализе рандомизированных исследований получены доказательства того, что иАПФ и сартаны способны снижать частоту появления новых приступов фибрилляции предсердий по сравнению с плацебо. Преимущества в отношении риска возникновения фибрилляции предсердий у лиц с систолической СН по сравнению с плацебо были продемонстрированы для эналаприла в исследовании SOLVD, для валсартана в исследовании Val-HeFT, однако эти исследования проводились достаточно давно, когда стандарты лечения больных с СН существенно отличались от современных, не включали b-блокаторы. Именно на этом основывались сомнения в том, что сартаны будут обладать дополнительными преимуществами для профилактики возникновения пароксизмов фибрилляции предсердий при назначении их на фоне адекватной терапии СН. Эти сомнения рассеялись после опубликования результатов исследования CHARM. У больных с симптомной СН, получающих современную терапию, назначение кандесартана приводило к снижению относительного риска развития фибрилляции предсердий на 19% по сравнению с плацебо (ОР 0,812, 95% ДИ 0,662-0,998, p=0,048) . В подгруппе пациентов со сниженной ФВ также наблюдалось достоверное снижение риска возникновения фибрилляции предсердий на 22%. Мета-анализ исследований, посвященных этой проблеме, продемонстрировал, что чем в большей степени снижена фракция выброса, тем большее протективное действие в отношении риска развития фибрилляции предсердий оказывают препараты, блокирующие РААС .
Помимо уменьшения риска возникновения новых эпизодов фибрилляции предсердий, сартаны способны предотвращать появление рецидивов при пароксизмальной форме заболевания. Сартаны и иАПФ могут обладать непосредственным антиаритмическим эф-фек-том, поскольку ангиотензин II способен напрямую участвовать в процессе электрического ремоделирования предсердий, даже в отсутствие СН. Так, снижение рефрактерного периода предсердий, наблюдаемое в эксперименте на фоне частой стимуляции предсердий, может быть предотвращено назначением средств, подавляющих активность РААС. Назначение ирбесартана дополнительно к амиодарону за 3 недели до плановой кардиоверсии пациентам с персистирующей фибрилляцией предсердий снижает вероятность развития рецидива пароксизмов фибрилляции предсердий по сравнению с терапией амиодароном без ирбесартана (17% vs 37%, p=0,008) . Максимальный эффект сартанов наблюдался в течение первых 2 месяцев лечения, что подтверждает роль блокады эффектов ангиотензина II в отношении процессов электрического ремоделирования предсердий в раннем периоде после кардиоверсии.
Для оценки преимуществ одного класса над другим в профилактике развития нарушений ритма, а также оценки роли средств, влияющих на РААС, в лечении фибрилляции предсердий требуется проведение дальнейших исследований.
Нефропротективный
потенциал сартанов
Уменьшение протеинурии ассоциировано с замедлением прогрессирования хронической болезни почек. Накоплено достаточно данных, свидетельствующих о том, что и сартаны, и иАПФ способны оказывать положительное влияние на функциональное состояние почек. Рено-протективные свойства присущи и классу антагонистов кальциевых каналов. Имеются ли преимущества назначения того или иного класса препарата? В нескольких крупных рандомизированных исследованиях убедительно доказано, что сартаны эффективно противостоят прогрессированию поражения почек. В исследовании IDNT были изучены свойства ирбесартана у 1715 больных с сахарным диабетом 2 типа и нефропатией . Эффекты препарата в дозе 300 мг сравнивались с действием амлодипина 10 мг и плацебо в течение 2,6 лет. Частота достижения конечных точек при применении ирбесартана в целом была на 20% ниже, чем в группе плацебо, и на 23% ниже, чем в группе амлодипина. При этом риск удвоения исходного уровня креатинина был ниже, чем в указанных группах на 33% и 37%, соответственно, а риск развития терминальной ХПН - на 23%. Нефропротективный эффект ирбесартана в исследовании IDNT, как и лозартана в исследовании RENAAL, не зависел от уровня АД. В исследовании IRMA-2 у больных АГ и сахарным диабетом 2 типа зарегистрировано значительное снижение частоты развития микроальбуминурии, независимого фактора риска сердечно-со-судистых заболеваний. Снижение риска прогрессирования диабетической нефропатии проявлялось независимо от антигипертензивного эффекта препарата.
Kunz R. et al., проанализировав результаты 59 ис-следований (6181 пациент), посвященных сравнению нефропротективного потенциала иАПФ, сартанов и антагонистов кальциевых каналов у лиц с хроническим заболеванием почек, пришли к выводу, что АРА II и иАПФ оказались одинаково эффективны в снижении протеинурии, а при сравнении с антагонистами кальциевых рецепторов преимущество оказалось на стороне АРА II . Сартаны уменьшали протеинурию независимо от степени ее выраженности и причины развития.
Заключение
На сегодняшний день эффективность сартанов в терапии АГ не вызывает сомнений. При этом абсолютно обоснованным является расширение показаний к назначению АРА II, которые шагнули за рамки класса антигипертензивных препаратов и доказали свою способность улучшать прогноз пациентов, оказывая положительное влияние на различных этапах кардио-ре-нального континуума. Существует гипотеза о пользе назначения сартанов у больных с систолической сердечной недостаточностью, перенесших инфаркт миокарда, а предварительные результаты исследования I-PRESERVE позволяют предполагать, что и у больных с нарушением диастолической функции назначение ирбесартана будет способствовать обратному развитию ремоделирования и восстановлению процессов релаксации миокарда, тем самым снижая выраженность симптомов застойной СН. Помимо этого способность ирбесартана влиять на процессы электрического ремоделирования предсердий, уменьшая вероятность возникновения пароксизмов фибрилляции предсердий, позволяет рекомендовать назначение АРА II лицам с пароксизмальной формой фибрилляции предсердий. Сартаны обладают нефропротективным действием у лиц с диабетической нефропатией и хроническим заболеванием почек, при этом эффект не зависит от степени снижения АД.
Потребность в назначении комбинированной терапии имеется у двух третей пациентов, страдающих АГ, что заставляет искать эффективные и хорошо переносимые сочетания лекарственных препаратов. Одной из предпочтительных комбинаций является назначение АРА II совместно с гидрохлоротиазидом, в частности, применение ирбесартана с гидрохлоротиазидом в исследовании INCLUSIVE позволило достичь целевого АД у 69% пациентов, у которых монотерапия была неэффективна. Все шире становится спектр показаний к назначению комбинированной терапии в дебюте лечения, что позволяет не только значительно повысить эффективность и ускорить достижение целевых цифр АД, но и обладает возможностью взаимного нивелирования нежелательных побочных реакций. К фиксированным комбинациям препаратов предъявляются достаточно высокие требования: они должны обладать лучшей способностью снижать АД и лучшим профилем безопасности по сравнению с монотерапией в средних дозах каждым из компонентов. Накопленная доказательная база позволила впервые в 2007 г. Амери-кан-скому управлению по контролю за продуктами питания и лекарствами (FDA) с целью достижения целевых значений АД рекомендовать полнодозовую фиксированную комбинацию ирбесартана с гидрохлортиазидом в качестве терапии первой линии не только больным с тяжелой АГ, но и всем пациентам с АГ 2 степени, и тем, кому потенциально потребуется назначение двух и более препаратов для достижения целевых цифр АД .

Литература
1. 2007 Guidelines for the management of arterial hypertension. J Hypertension 2007;25:1105-1187.
2. Matchar DB, McCrory DC, Orlando LA et al. Systematic review: comparative effectiveness of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers for treating essential hypertension. Ann Int Med 2008;148:16-29.
3. Blood Pressure Lowering Treatment Trialists Collaboration. Blood pressure dependent and independent effects of agents that inhibit the renin-angiotensin system. J Hypertens 2007;25:951-958.
4. Dahlof B, Devereux RB, Kristiansson K et al. LIFE study group. Cardiovascular morbidity and mortality in the losartan intervention for endpoint reduction in hypertension study: a randomized trial against atenolol Lancet 2002;359:995-1003.
5. Lithell H, Hansson L, Scoog I et al. SCOPE study group. The study on cognition and prognosis in the elderly (SCOPE). Principal results of a randomized double-blind interventional trial. J Hypertension 2003;21:875-886.
6. Schrader J, Lunders S, Kulschewski A et al. for MOSES study group. Morbidity and mortality after stroke. Eprosartan compared with nitrendipine for secondary prevention: principal results of a prospective randomized controlled study (MOSES). Stroke 2005;36:1218-26.
7. Julius S, Kjeldsen SE, Weber M et al. VALUE trial group. Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial. Lancet 2004;363:2022-2031.
8. Bobrie G, Delonca J, Moulin C et al. Comparative study of efficasy of irbesartan/HCTZ with valsartan/HCTZ using home blood pressure monitoring in the treatment of mild-to-moderate hypertenison (COSIMA). Am J Hypertens 2005;18(11):1482-1488.
9. Flack JM. Maximaising antihypertensive effects of angiotensin II receptor blockers with thiazide diuretic combination therapy: focus on irbesartan/hydrochlorothiazide.Int J Clin Pract 2007;61(12):2093-2102. .
10. Pitt B, Poole-Wilson PA, Segl R on behalf of the ELITE II investigators. Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomised trial - the Losartan Heart Failure Survival Study ELITE II. Lancet 2000;355:1582-1587.
11. Dickstein K, Kjekshus J, and the OPTIMAAL Steering Committee for the OPTIMAAL Study Group. Effects of losartan and captopril on mortality and morbidity high-risk patients after acute myocardial infarction: the OPTIMAAL randomised trial. Lancet 2002;360:752-760.
12. Preffer MA, McMurray JJV, Velasquez EJ et al. For the Valsartan in Acute Myocardial Infarction Trial Investigators. Valsartan, Captopril or both in myocardial infarction complicated by the heart failure, left ventricular dysfunction, or both. N Eng J Med 2003;349:1893-1906.
13. Carson P, Massie BM, McKelvie R, et al; for the I-PRESERVE Investigators. The irbesartan in heart failure with preserved systolic function (I-PRESERVE) trial: rationale and design. J Card Fail. 2005;11:576-585.
14. Aurigemma GP, Gaasch WH. Diastolic heart failure. N Engl J Med. 2004;351:1097-1105.
15. Bonow RO, Udelson JE. Left ventricular diastolic dysfunction as a cause of congestive heart failure. Mechanisms and management. Ann Intern Med. 1992;117:502-510. Grossman W. Diastolic dysfunction in congestive heart failure. N Engl J Med. 1991;325:1557-1564.
16. Yusuf S, Pfeffer MA, Swedberg K, et al; CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet. 2003;362:777-781.
17. The ONTARGET Investigators. Telmisartan, Ramipril, or both in patients at hgh risk for vascular events. New Eng J Med 2008;358:1547-1559.
18. Wyse DG, Waldo AL, DiMarco JP et al. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002;347:1825-1833.
19. Van Gelder IC, Hagens VE, Bosker HA et al. A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N Engl J Med 2002;347:1834-1840.
20. Goette A, Staack T, Rocken C et al. Increased expression of extracellular signal-regulated kinase and angiotensin-converting enzyme in human atria during atrial fibrillation. J Am Coll Cardiol 2000;35:1669-1677.
21. Zou Y, Komuro I, Yamazaki T, et al. Cell type-specific angiotensin II-evoked signal transduction pathways: critical roles of Gbetagamma subunit, Src family, and Ras in cardiac fibroblasts. Circ Res 1998;82:337-45.
22. Pages G, Lenormand P, L’Allemain G, et al. Mitogen-activated protein kinases p42mapk and p44mapk are required for fibroblast proliferation. Proc Natl Acad Sci U S A 1993;90:8319-23.
23. McEwan PE, Gray GA, Sherry L et al. Differential effects of angiotensin II on cardiac cell proliferation and intramyocardial perivascular fibrosis in vivo. Circulation 1998;98:2765-2773.
24. Goette A, Arndt M, Rocken C et al. Regulation of angiotensin II receptor subtypes during atrial fibrillation in humans. Circulation 2000;101:2678-2681.
25. Webster MW, Fitzpatrick MA, Nicholls MG et al. Effect of enalapril on ventricular arrhthmias in congestive heart failure. Am J Cardiol 1985;56:566-569.
26. Ducharme A, Swedberg K, Pfeffer MA et al. Prevention of atrial fibrillation in patients with symptomatic chronic heart failure by candesartan in the Candesartan in Heart failure: Assessment of Reduction in Mortality and morbidity (CHARM) program. Am Heart J 2006;152:86-92.
27. Healey J, Baranchuk A, Crystal E et al. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers. A meta-analysis. J Am Coll Card 2005;45:1832-1838.
28. Madrid AH, Bueno MG, Rebollo JM, et al. Use of irbesartan to maintain sinus rhythm in patients with long-lasting persistent atrial fibrillation: a prospective and randomized study. Circulation 2002;106:331-336.
29. Lewis EJ, Hunsicker LG, Clarke WR et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. New Eng J Med 2001; 345: 851-860.
30. Kunz R, Friedrich C, Wolbers M et al. Meta-analysis: effect of monotherapy and combination therapy with inhibitors of the rennin-angiotensin system on proteinuria in renal disease. Ann Int Med 2008;148:30-48.
31. Neutel J.M. et al. J. Clin. Hypertens 2005; 7 (10): 578-86.
32. http://www.medscape.com/viewarticle/555485
ТАнгиотензин – гормон, вырабатываемый почками, его действие направлено на сужение сосудов. При повышенной его концентрации может подниматься артериальное давление. В таком случае эффективными будут препараты, блокирующие действие гормона.
Общие сведения
Блокаторы ангиотензиновых рецепторов (АРА) – новый класс препаратов, которые регулируют и нормализуют артериальное давление. Не уступают по эффективности препаратам с аналогичным спектром действия, но в отличие от них имеют один неоспоримый плюс – практически не имеют побочных эффектов.
Среди положительных свойств препаратов можно также отметить то, что они благотворно влияют на прогноз пациента страдающего гипертонией, способны защищать мозг, почки и сердце от поражений.
Наиболее распространенные группы лекарств:
- сартаны;
- антагонисты рецепторов ангиотензина;
- блокаторы рецепторов ангиотензина.

Исследования этих препаратов, на данный момент, находятся пока ещё только в начальной стадии и будут продолжаться на протяжении ещё, как минимум, 4 лет. Существуют некоторые противопоказания к применению блокаторов рецепторов ангиотензина 2.
Применение препаратов недопустимо при беременности и во время кормления грудью, при гиперкалиемии, а также пациентам с тяжёлой формой почечной недостаточности и двухсторонним стенозом почечных артерий. Нельзя применять эти препараты детям.
Классификация препаратов
Блокаторы рецепторов ангиотензина по химическим составляющим можно разделить на 4 группы:
- Телмисартан. Небифиниловое производное тетразола.
- Эпросартан. Небифениловый нететразол.
- Валсартан. Нециклическое соединение.
- Лозартан, Кандесартан, Ирбесартан. Эта группа относится к бифениловым производным тетразола.

Существует множество торговых названий сартанов. Некоторые из них приведены в таблице:
Как действуют блокаторы?
Во время того, как артериальное давление начинает понижаться в почках, на фоне гипоксии (нехватке кислорода) вырабатывается ренин. Он оказывает влияние на неактивный ангиотензиноген, который трансформируется в ангиотензин 1. На него действует ангиотензинпревращающий фермент, который и переходит в форму ангиотензина 2.

Вступая в связь с рецепторами, ангиотензин 2 резко повышает артериальное давление. АРА действуют на эти рецепторы, из-за чего и снижается давление.
Блокаторы рецепторов ангиотензина не только борются с гипертензией, но и оказывают такое действие:
- уменьшение гипертрофии левого желудочка;
- уменьшение желудочковой аритмии;
- уменьшение инсулинорезистенции;
- улучшение диастолической функции;
- снижение микроальбуминурии (выделение белка с мочой);
- улучшение работы почек у пациентов с диабетической нефропатией;
- улучшение кровообращения (при хронической сердечной недостаточности).
Сартаны могут быть использованы для профилактики структурных изменений в тканях почек и сердца, а также атеросклероза.
Кроме того, АРА в своём составе могут содержать активные метаболиты. В некоторых препаратах активные метаболиты действуют дольше самих лекарств.

Показания к применению
Применение блокаторов рецепторов ангиотензина 2 рекомендовано пациентам со следующими патологиями:
- Артериальная гипертензия. Гипертоническая болезнь – главное показание к применению сартанов. Антагонисты ангиотензиновых рецепторов хорошо переносятся пациентами, этот эффект можно сравнить с плацебо. Практически не вызывают неконтролируемую гипотензию. Также эти препараты, в отличие от бета-блокаторов, не влияют на обменные процессы и на половую функцию, отсутствует аритмогенный эффект. В сравнение с ингибиторами ангиотензинпревращающего фермента, АРА практически не вызывают кашель и ангионевротический отёк, не повышают концентрацию калия в крови. Блокаторы рецепторов ангиотензина редко вызывают толерантность к препарату у пациентов. Максимальный и стойкий эффект от приёма препарата наблюдается через две–четыре недели.
- Поражение почек (нефропатия). Эта патология является осложнением гипертонии и/или сахарного диабета. На улучшение прогноза влияет уменьшение выделенного белка в моче, что замедляет процесс развития почечной недостаточности. Согласно последним исследованиям АРА уменьшают протеинурию (выделение белка с мочой), защищая почки, но эти результаты ещё не до конца доказаны.
- Сердечная недостаточность. Развитие этой патологии обусловлено активностью . В самом начале заболевания это улучшает деятельность сердца, выполняя компенсаторную функцию. В ходе развития болезни происходит ремоделирование миокарда, что, в конечном счете, приводит к его дисфункции. Лечение при помощи блокаторов ангиотензиновых рецепторов при сердечной недостаточности обусловлено тем, что они способны избирательно подавлять активность ренин-ангиотензин-альдостероновой системы.

Кроме того, среди показаний к применению блокаторов ангиотензиновых рецепторов являются такие заболевания:
- инфаркт миокарда;
- диабетическая нефропатия;
- метаболический синдром;
- фибрилляция предсердий;
- непереносимость ингибиторов АПФ.
Дополнительные эффекты
Среди действий блокаторов рецепторов ангиотензина 2 отмечается также сниженный уровень холестерин липопротеидов низкой плотности и общего холестерина, улучшая показатели липидного обмена. Также эти препараты снижают показатели мочевой кислоты в крови.
Сартаны обладают следующими дополнительными клиническими эффектами:
- аритмический эффект;
- защита клеток нервной системы;
- метаболические эффекты.
Побочные эффекты от приема блокаторов
Блокаторы рецепторов ангиотензина 2 отличаются хорошей переносимостью организмом больного. В принципе, эти препараты не имеют специфических побочных эффектов, в отличие от других групп препаратов аналогичного действия, но могут вызывать аллергические реакции, как и любой другой препарат.
Среди немногочисленных побочных эффектов можно отметить следующие:
- головокружение;
- головная боль;
- бессонница;
- боль в животе;
- тошнота;
- рвота;
- запор.

В редких случаях пациент может наблюдать у себя такие расстройства:
- болезненные ощущения в мышцах;
- боли в суставах;
- повышение температуры тела;
- проявление симптомов ОРВИ (насморк, кашель, боль в горле).
Иногда отмечаются побочные эффекты со стороны мочеполовой и сердечно-сосудистой систем.
Особенности применения
Как правило, препараты, блокирующие ангиотензиновые рецепторы, выпускают форме таблеток, пить которые можно не зависимо от приёма пищи. Максимально устойчивая концентрация препарата достигается спустя две недели регулярного приёма. Срок выведения из организма – минимум 9 часов.
Блокаторы ангиотензина 2 могут отличаться между собой по спектру действия.
Особенности приема Лозартана
Курс лечения гипертензии составляет 3 недели и более, в зависимости от индивидуальных особенностей.

Кроме того, этот препарат снижает концентрацию мочевой кислоты в крови и выводит воды натрия из организма. Дозировка корректируется лечащим врачом исходя из следующих показателей:
- Комбинированное лечение, включающее применение этого препарата с диуретиками, предполагает употребление не более 25 мг. в сутки.
- При возникновении побочных эффектов, таких как головная боль, головокружение, снижение артериального давления дозировку препарата необходимо снизить.
- У пациентов с печёночной и почечной недостаточностью препарат назначают с осторожностью и в малых дозах.
Противопоказания к приему Валсартана
Препарат воздействует только на рецепторы АТ-1, блокируя их. Эффект от однократного приёма достигается спустя 2 часа. Назначается только лечащим врачом, так как существует риск того, что препарат может навредить.
С осторожностью подходить к использованию препарата следует пациентам, у которых наблюдаются такие патологии:
- Непроходимость жёлчных путей. Препарат выводится из организма с желчью, поэтому больным, у которых наблюдаются нарушения в работе этого органа, не рекомендуется применение валсартана.
- Реноваскулярная гипертензия. У пациентов с этим диагнозом необходим контроль уровня мочевины сыворотке крови, а также креатинина.
- Дисбаланс водно-солевого обмена. В этом случае в обязательном порядке требуется коррекция этого нарушения.
Важно! При использовании Валсартана у пациента могут наблюдаться такие симптомы, как кашель, отёки, диарея, бессонница, снижение половой функции. Во время приёма препарата появляется риск развития различных вирусных инфекций.
С осторожностью следует принимать препарат во время выполнения работ, требующих максимальной концентрации внимания.
Назначение Иберсартана
Действие препарата направлено на:
- уменьшение нагрузки на сердце;
- устранение сосудосуживающего действия ангиотензина 2;
- снижение .
Эффект от приема этого препарата достигается по истечении 3 часов. После завершения курса приёма Иберсартана артериальное давление планомерно возвращается к своей исходной величине.
Иберсартан не предотвращает развитие атеросклероза, в отличие от большинства антагонистов рецепторов ангиотензина, так как не влияет на липидный обмен.
Важно! Препарат предполагает ежедневный приём в одно и то же время. При пропуске приёма удваивать дозу категорически не рекомендуется.
Побочные реакции при приёме Иберсартана:
- головная боль;
- тошнота;
- головокружение;
- слабость.

Эффективность Эпросартана
При лечении гипертензии оказывает мягкий и стойкий эффект на протяжении суток. При прекращении приёма не наблюдается резких скачков давления. Эпросартан назначают даже при сахарном диабете, так как он не влияет на уровень сахара в крови. Препарат также можно принимать пациентам с почечной недостаточностью.
Эпросартан имеет следующие побочные эффекты:
- кашель;
- насморк;
- головокружение;
- головная боль;
- диарея;
- боль за грудиной;
- одышка.
Побочные реакции, как правило, носят кратковременный характер и не требуют корректировки дозы или полной отмены препарата.

Особенности приема Телмисартана
Наиболее сильный препарат среди сартанов. Вытесняет ангиотензин 2 из связи с рецепторами АТ-1. Может назначаться пациентам с нарушением в работе почек, при этом дозировка не меняется. Однако в некоторых случаях может вызывать гипотонию даже в малых дозах.
Телмисартан противопоказан пациентам с такими нарушениями:
- первичный альдостеронизм;
- тяжёлые нарушения функции печени и почек.
Не назначают препарат во время беременности и в период лактации, а также детям и подросткам.
Среди побочных эффектов применения Телмисартана можно отметить:
- диспепсию;
- диарею;
- ангионевротический отёк;
- боли в пояснице;
- боли в мышцах;
- развитие инфекционных заболеваний.
Телмисартан относится к группе препаратов, которые действуют по накоплению. Максимальный эффект от применения может быть достигнут спустя месяц регулярного приёма препарата. Поэтому важно не корректировать самостоятельно дозировку в первые недели приёма.
Несмотря на то, что препараты, блокирующие ангиотензиновые рецепторы имеют минимум противопоказаний и побочных эффектов принимать их следует с осторожностью ввиду того, что эти средства находятся ещё на стадии изучения. Корректную дозу для лечения повышенного артериального давления у больного может назначать исключительно лечащий врач, так как самолечение может привести к нежелательным последствиям.
Антагонисты рецепторов к ангиотензину II: новые перспективы клинического использования
И. Г. Березняков
Харьковская медицинская академия последипломного образования
Антагонисты рецепторов к ангиотензину II (АРА II) внедрены в клиническую практику в начале 90-х годов прошлого века. Уже в 1997 г. в США они были включены в перечень основных антигипертензивных средств. Спустя 2 года Всемирная организация здравоохранения (ВОЗ) и Международное общество по изучению гипертензии (МОИГ) присоединились к мнению американских экспертов. Перечень показаний к применению АРА II продолжает расширяться. В 2001 г. FDA (Комиссия по контролю качества продуктов питания и лекарственных средств США) одобрила применение лосартана для торможения сроков наступления терминальной хронической почечной недостаточности, а вальсартана - у больных с хронической сердечной недостаточностью (в случае непереносимости ингибиторов ангиотензинпревращающего фермента). В Украине зарегистрированы 4 препарата этой группы, и это, по-видимому, не предел. Таким образом, есть все основания присмотреться к ним повнимательнее.
Ренин-ангиотензиновая система (РАС)
РАС принимает активное участие в регуляции артериального давления (АД). Ключевым элементом этой системы является ангиотензин II (A II), который образуется из неактивного ангиотензина I или даже ангиотензиногена под действием различных ферментов (схема). Основные эффекты А II направлены на повышение АД. Он оказывает непосредственное сосудосуживающее действие, стимулирует активность симпатико-адреналовой системы, повышает чувствительность гладкомышечных клеток сосудов к циркулирующим катехоламинам, стимулирует выработку альдостерона (самого мощного минералокортикоида), способствует задержке ионов натрия в организме. Обнаружение ангиотензинпревращающего фермента (АПФ), под влиянием которого в плазме крови из неактивного ангиотензина I образуется A II, позволило определить новую мишень для фармакологического воздействия. Так появились ингибиторы АПФ, которые ознаменовали значительный прогресс в лечении не только артериальной гипертензии, но и хронической сердечной недостаточности, диабетической и недиабетической нефропатии и многих других заболеваний. Использование ингибиторов АПФ, тем не менее, не позволяло добиться полной блокады образования А II в организме. Вскоре выяснилось, что он образуется не только в крови под действием АПФ, но и в тканях,- под влиянием уже других ферментов. В ходе изучения эффектов A II удалось установить, что в органах и тканях он связывается со специфическими рецепторами, причем все основные прессорные (повышающие АД) эффекты реализуются через связывание с рецепторами 1-го типа (АТ1).
В настоящее время описаны рецепторы еще 3-х типов, однако их функции еще предстоит изучить. В частности, стимуляция рецепторов 2-го типа (АТ2) вызывает ряд эффектов, противоположных тем, которые развиваются при стимуляции рецепторов 1-го типа. Таким образом, создание препаратов, блокирующих АТ1-рецепторы, представляет собой привлекательную альтернативу ингибиторам АПФ, поскольку позволяет подавить неблагоприятные эффекты А II вне зависимости от того, образовался ли он в крови или в тканях. Дополнительные возможности открываются при одновременной стимуляции АТ2-рецепторов. Кроме того, ингибиторы АПФ удлиняют сроки циркуляции в крови брадикинина, с чем связывают некоторые побочные эффекты при использовании этих препаратов, в частности сухой кашель. Специфическая блокада АТ1-рецепторов не влияет на метаболизм брадикинина в организме, что позволяет прогнозировать лучшую переносимость подобных препаратов. Изложенное послужило теоретическим основанием для разработки и внедрения в клиническую практику специфических АРА II.
АРА II: сравнительная характеристика
По химическому строению различают следующие АРА II:
- бифенилтетразолы (лосартан, ирбесартан, кандесартан);
- небифениловые тетразолы (телмисартан, эпросартан);
- негетороциклические соединения (вальсартан).
Лосартан (козаар) и кандесартан являются пролекарствами (т. е. превращаются в активные соединения непосредственно в организме человека). В процессе метаболизма обоих препаратов образуются вещества, обладающие фармакологической активностью. В отличие от лосартана и кандесартана, вальсартан (диован) изначально обладает фармакологической активностью и не имеет активных метаболитов. Кроме того, вальсартан является неконкурентным (insurmountable) антагонистом А II и обладает самым высоким сродством к АТ1-рецепторам. Это означает, что высокие концентрации А II не способны вытеснять вальсартан из мест связывания с АТ1-рецепторами, а стимуляция незаблокированных АТ2-рецепторов циркулирующим А II может вызывать дополнительные позитивные эффекты.
Применение АРА II при артериальной гипертензии
Эпидемиологические исследования свидетельствуют, что артериальная гипертензия (АГ) регистрируется у 15–30% взрослого населения планеты. Существуют определенные географические различия в распространенности этого заболевания. Так, в некоторых странах Африки повышенные цифры АД выявляются у 6% взрослого населения, в то время как в Скандинавских странах эта цифра в 5–6 раз больше. В 2000 г. в Украине зарегистрировано 7 645 306 больных АГ, что составляет около 18,8% взрослого населения. При этом распространенность АГ в Украине выросла на 40% по сравнению с 1997 г. и на 18% - по сравнению с 1999 г. .
В рекомендациях Комитета экспертов ВОЗ и МОИГ (1999) по диагностике и лечению АГ в качестве средств 1-го ряда были перечислены 6 классов антигипертензивных средств: диуретики, β-адреноблокаторы, антагонисты кальция, ингибиторы АПФ, α-адреноблокаторы и АРА II. Предполагалось, что все они обладают равной способностью снижать АД и предупреждать возникновение сердечно-сосудистых осложнений АГ. Клинические исследования, завершенные на то время, свидетельствовали, что ни антагонисты кальция, ни ингибиторы АПФ не уступают диуретикам и β-адреноблокаторам (но и не превосходят их) по способности снижать у больных АГ риск смерти от сердечно-сосудистых причин и возникновение тяжелых сердечно-сосудистых заболеваний (таких как инфаркт миокарда и инсульт). Диуретики и β-адреноблокаторы были выбраны в качестве препаратов сравнения потому, что польза от их использования при АГ была убедительно доказана в ходе масштабных и хорошо спланированных клинических исследований.
В 2000 г. появились первые сомнения в «равноправии» всех шести классов основных антигипертензивных средств. В крупномасштабное исследование ALLHAT (его название переводится как исследование антигипертензивного и липидоснижающего лечения для предупреждения сердечных приступов) было включено 42 тыс. больных АГ с высоким риском сердечно-сосудистых заболеваний. Основной задачей этого исследования было выяснить, снижают ли антагонисты кальция (амлодипин), ингибиторы АПФ (лизиноприл) и α1-адреноблокаторы (доксазозин) сердечно-сосудистую заболеваемость и смертность по сравнению с диуретиком (хлорталидон). В 2000 г. исследование было досрочно прекращено в группе больных, получавших доксазозин. На тот момент в этой группе под наблюдением находились 9067 пациентов. При сравнении результатов лечения, АГ у больных, получавших доксазозин, и у больных, получавших хлорталидон (15268 человек), была установлена равная антигипертензивная эффективность обоих препаратов. В частности, систолическое АД снизилось соответственно до 137 и 134 мм рт. ст. (различия статистически недостоверны). Однако в группе больных, получавших доксазозин, сердечно-сосудистую заболеваемость и смертность оказалась на 25% выше (p < 0,0001), а риск возникновения инсульта - на 19% выше (p = 0,04), чем у больных, получавших хлорталидон. Был сделан вывод, что α1-адреноблокаторы, в частности доксазозин, уступают диуретикам по способности предупреждать сердечно-сосудистые осложнения АГ и, следовательно, не должны рассматриваться в качестве средств 1-го ряда в лечении этого заболевания.
В марте этого года опубликованы результаты исследования LIFE (Losartan Intervention For Endpoint reduction in hypertension study), которые, по-видимому, вызовут серьезный пересмотр современных представлений о роли различных классов антигипертензивных средств в лечении АГ . В этом исследовании было впервые показано, что АРА II (лосартан) превосходят β-адреноблокаторы (атенолол) по способности предупреждать сердечно-сосудистую заболеваемость и смертность у больных АГ. На сегодняшний день доказательств подобного рода нет ни для одного класса антигипертензивных средств.
В исследование LIFE было включено 9193 больных АГ в возрасте 55–80 лет с АД в положении сидя 160–200/95–115 мм рт. ст. Обязательным условием включения было наличие признаков гипертрофии левого желудочка на ЭКГ, т. е. все пациенты относились к группе повышенного риска неблагоприятных исходов. Лосартан назначался в дозе 50–100 мг/сут. и при необходимости комбинировался с гидрохлоротиазидом по 12,5–25 мг/сут. Препарат сравнения - атенолол - также применялся по 50–100 мг/сут. В случае надобности к нему добавлялся гидрохлоротиазид по 12,5–25 мг/сут. Все препараты назначались 1 раз в сутки. Длительность наблюдения составила в среднем 4,8 ± 0,9 лет.
Целью исследования было сравнить сердечно-сосудистую заболеваемость и смертность (смерть от сердечно-сосудистых причин + инфаркт миокарда + инсульт) в группах больных, получавших лосартан и атенолол.
В группе больных, получавших лосартан, установлено достоверное снижение сердечно-сосудистой заболеваемости и смертности по сравнению с группой пациентов, получавших атенолол. Это снижение было достигнуто, главным образом, за счет уменьшения числа инсультов. Кроме того, частота вновь диагностированного сахарного диабета в группе лосартана была на 25% ниже, а переносимость лосартана оказалась достоверно лучше, чем атенолола.
При подтверждении полученных результатов в других сравнительных исследованиях АРА II с антигипертензивными препаратами иных классов стратегия и тактика лечения АГ будет в корне пересмотрена. Одним из таких исследований, в частности, является VALUE, в котором вальсартан сравнивается с амлодипином у 15320 больных АГ, относящихся к группе высокого риска. Завершение этого исследования ожидается в 2004 г.
Еще одним достоинством АРА II является благоприятное влияние на половую функцию. На сегодняшний день убедительно доказано, что распространенность сексуальных проблем у мужчин с нелеченой АГ значительно выше, чем у мужчин с нормальными величинами АД. Более того, риск половой дисфункции возрастает на фоне лечения диуретиками, центральными симпатолитиками (метилдофа, клонидин) и β-адреноблокаторами (в особенности, неселективными). В сравнительных исследования вальсартана и лосартана с β-адреноблокаторами показано, что АРА II не вызывают ухудшения половой функции, в отличие от препаратов сравнения, причем различия достигают статистической значимости. Более того, вальсартан по способности влиять на половую функцию не отличается от плацебо .
Применение АРА II при сахарном диабете
Сахарный диабет по праву можно рассматривать как сердечно-сосудистое заболевание. Наличие сахарного диабета II типа увеличивает риск ИБС в 2–3 раза у мужчин и в 4–5 раз у женщин . Сахарный диабет почти в 5 раз повышает риск неблагоприятных исходов (смерть, инфаркт миокарда, повторная госпитализация в течение 1-го года) при остром коронарном синдроме. Риск смерти у больных сахарным диабетом, не переносивших инфаркт миокарда, не отличается от такового у пациентов, которые перенесли инфаркт миокарда, но не страдают сахарным диабетом. Доля макрососудистых осложнений (прежде всего, инфарктов миокарда и инсультов) в структуре смертности у больных сахарным диабетом II типа достигает 65%.
Одним из тяжелых и неуклонно прогрессирующих осложнений сахарного диабета является диабетическая нефропатия. В исследованиях, проведенных в прошлые годы, была убедительно продемонстрирована способность ингибиторов АПФ тормозить сроки наступления терминальной хронической почечной недостаточности у больных с диабетической нефропатией. В 2001 г. опубликованы результаты исследования RENAAL, в которое были включены 1513 больных сахарным диабетом II типа в возрасте 31–70 лет, у которых имели место альбуминурия (потеря с мочой более 300 мг/сут. белка) и нарушение функции почек. 751 человек получал лосартан по 50–100 мг/сут., 762 пациента - плацебо. Длительность наблюдения составила в среднем 3,5 г. За это время частота развития терминальной хронической почечной недостаточности в группе активного лечения оказалась на 28% ниже. По-видимому, способность тормозить сроки наступления терминальной хронической почечной недостаточности является свойством, присущим всем АРА II, поскольку результаты, близкие к достигнутым в RENAAL, были получены также в исследованиях MARVAL (с вальсартаном), IDNT (с ирбесартаном) и других.
Применение АРА II при хронической сердечной недостаточности
Хроническая сердечная недостаточность (ХСН) представляет собой весьма серьезную клиническую проблему, прежде всего, из-за крайне неблагоприятного прогноза. Так, смертность в течение 5 лет при наличии ХСН составляет 26–75%, причем 34% больных с ХСН умирают вследствие перенесенного инсульта или инфаркта миокарда.
Исследования АРА II при ХСН, выполненные до прошлого года, оказались сравнительно неудачными. В частности, в исследовании ELITE II, спланированном для доказательства превосходства лосартана над ингибитором АПФ каптоприлом, подтвердить эту гипотезу не удалось. Досрочно было прекращено и исследование RESOLVD, в котором кандесартан сравнивался с эналаприлом – из-за более высокой смертности в группах больных, получавших кандесартан и особенно комбинацию этого препарата с эналаприлом.
В этой связи особого внимания заслуживает исследование Val-HeFT, в которое было включено 5010 больных с ХСН II–IV функционального класса по классификации Нью-Йоркской ассоциации сердца . Все пациенты получали современную и эффективную терапию ХСН (ингибиторы АПФ - более 90% больных, β-адреноблокаторы - около трети). Добавление к этой терапии вальсартана по сравнению с плацебо привело к снижению числа госпитализаций по поводу утяжеления ХСН, улучшению качества жизни и объективной симптоматики (одышки, хрипов в легких и т. д.). Особенно значительного эффекта достигали у тех больных, кто получал либо ингибитор АПФ, либо β-адреноблокатор, либо не принимал ни одного из перечисленных средств. В то же время добавление вальсартана пациентам, принимавшим и ингибитор АПФ, и β-адреноблокатор, приводило к ухудшению течения заболевания. Полученные результаты позволили FDA одобрить применение вальсартана у больных ХСН, которые не получают ингибиторы АПФ (например, из-за побочных эффектов - кашель, ангионевротический отек и др.).
Заключение
Накопленные на сегодняшний день данные свидетельствуют, что антагонисты рецепторов ангиотензина II - это не только безопасная альтернатива ингибиторам АПФ при лечении артериальной гипертензии. АРА II с успехом могут использоваться вместо ингибиторов АПФ (или вместе с ними) при лечении хронической сердечной недостаточности (вальсартан), для торможения сроков наступления терминальной хронической почечной недостаточности (лосартан), а при АГ они, возможно, являются наиболее эффективным классом антигипертензивных средств для снижения сердечно-сосудистой заболеваемости и смертности.
Литература
- Сiренко Ю. М. Артерiальна гiпертензiя 2002.- Київ: Морiон, 2002
- Dahlхf B. et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet 2002; 359: 995-1003.
- Fogari R., Zoppi A., Poletti L., Marasi G., Mugellini A., Corradi L. Sexual activity in hypertensive men treated with valsartan or carvedilol: a crossover study. Am. J. Hypertens. 2001; 14 (1): 27–31
- American Diabetes Association. Diabetes 1996 Vital Statistics. Chicago: Am. Diab. Ass.,1996, 29.
- Cohn J.N., Tognoni G. A randomized trial of angiotensin-receptor blocker valsartan in chronic heart failure. N. Engl. J. Med. 2001; 345 (23): 1667–75.
