Алдостеронът при хората е основният представител на минералкортикоидните хормони, производни на холестерола.
Синтез
Осъществява се в зоната гломерулоза на надбъбречната кора. Прогестеронът, образуван от холестерол, претърпява последователно окисление по пътя си до алдостерон. 21-хидроксилаза, 11-хидроксилаза и 18-хидроксилаза. В крайна сметка се образува алдостерон.

Схема за синтез стероидни хормони(пълна диаграма)
Регулиране на синтеза и секрецията
Активирате:
- ангиотензин II, освободени при активиране на системата ренин-ангиотензин,
- повишена концентрация калиеви йонив кръвта (свързано с деполяризация на мембраната, отваряне калциеви каналии активиране на аденилат циклаза).
Активиране на системата ренин-ангиотензин
- За да активирате тази система, има две начални точки:
- намаляване на наляганетов аферентните артериоли на бъбреците, което се определя барорецепториклетки на юкстагломеруларния апарат. Причината за това може да бъде всяко нарушение на бъбречния кръвен поток - атеросклероза бъбречни артерии, повишен вискозитеткръв, дехидратация, загуба на кръв и др.
- намаляване на концентрацията на Na + йонив първичната урина в дисталните тубули на бъбреците, което се определя от осморецепторите на клетките на юкстагломеруларния апарат. Възниква в резултат на диета без сол, при продължителна употреба на диуретици.
Постоянната и независима от бъбречния кръвен поток секреция на ренин (базална) се поддържа от симпатиковата нервна система.
- При изпълнение на една или и двете точки на клетката юкстагломеруларен апаратсе активират и от тях ензимът се отделя в кръвната плазма ренин.
- За ренин в плазмата има субстрат - протеин от α2-глобулиновата фракция ангиотензиноген. В резултат на протеолизата се образува декапептид т.нар ангиотензин I. На следващо място, ангиотензин I с участието ангиотензин конвертиращ ензим(APF) се превръща в ангиотензин II.
- Основните мишени на ангиотензин II са гладките миоцити кръвоносни съдове И zona glomerulosa cortexнадбъбречни жлези:
- стимулирането на кръвоносните съдове предизвиква техния спазъм и възстановяване кръвно налягане .
- секретирани от надбъбречните жлези след стимулация алдостерон, въздействащи върху дисталните тубули на бъбреците.
Когато алдостеронът действа върху бъбречните тубули, реабсорбцията се увеличава Na+ йони, следва натрий вода. В резултат на това налягането в кръвоносна системасе възстановява и концентрацията на натриеви йони се повишава в кръвната плазма и следователно в първичната урина, което намалява активността на RAAS.

Активиране на системата ренин-ангиотензин-алдостерон
Механизъм на действие
Цитозолен.
Цели и ефекти
Влияе слюнчените жлези, върху дисталните тубули и събирателните канали на бъбреците. Укрепва в бъбреците реабсорбция на натриеви йонии загуба на калиеви йони чрез следните ефекти:
- увеличава количеството на Na +,K + -ATPase върху базалната мембрана на епителните клетки,
- стимулира синтеза на митохондриални протеини и увеличаване на количеството енергия, генерирана в клетката за работата на Na +,K + -ATPase,
- стимулира образуването на Na канали върху апикалната мембрана на бъбречните епителни клетки.
Патология
Хиперфункция
Синдром на Кон(първичен алдостеронизъм) - възниква при аденоми на zona glomerulosa. Характеризира се с триада от симптоми: хипертония, хипернатремия, алкалоза.
Вторихипералдостеронизъм - хиперплазия и хиперфункция на юкстагломерулните клетки и прекомерна секреция на ренин и ангиотензин II. Има повишаване на кръвното налягане и появата на оток.
Който се образува в специални клетки на юкстагломеруларния апарат на бъбрека (JGA). Секрецията на ренин се стимулира от намаляване на обема на циркулиращата кръв, намаляване кръвно налягане, b 2 -агонисти, простагландини E 2 , I 2 , калиеви йони. Увеличаването на активността на ренин в кръвта причинява образуването на ангиотензин I, пептид от 10 аминокиселини, който се отцепва от ангиотензиногена. Ангиотензин I под действието на ангиотензин-конвертиращия ензим (ACE) в белите дробове и в кръвната плазма се превръща в ангиотензин II.
Той предизвиква синтеза на хормона алдостерон в зоната гломерулоза на надбъбречната кора. Алдостеронът навлиза в кръвта, транспортира се до бъбрека и действа чрез неговите рецептори върху дисталните тубули медулабъбреци Общият биологичен ефект на алдостерона е задържането на NaCl и вода. В резултат на това се възстановява обемът на течността, циркулираща в кръвоносната система, включително увеличаване на бъбречния кръвен поток. Това завършва отрицателната обратна връзка и синтезът на ренин спира. В допълнение, алдостеронът причинява загуба на Mg 2+, K +, H + в урината.Обикновено тази система поддържа кръвното налягане (фиг. 25).
Ориз. 25. Ренин-ангиотензин-алдостеронова система
Излишък на алдостерон - алдостеронизъм , може да бъде първичен или вторичен. Първичният алдостеронизъм може да бъде причинен от хипертрофия на зоната гломерулоза на надбъбречните жлези, ендокринна патология или тумор (алдостеронома). Вторичен алдостеронизъм се наблюдава при чернодробни заболявания (алдостеронът не се неутрализира и не се екскретира) или при заболявания на сърдечно-съдовата система, в резултат на което кръвоснабдяването на бъбрека се влошава.
Резултатът е същият - хипертония, а при хроничния процес алдостеронът предизвиква пролиферация, хипертрофия и фиброза на кръвоносните съдове и миокарда (ремоделиране), което води до хронична сърдечна недостатъчност. Ако е свързано с излишък на алдостерон, се предписват блокери на алдостеронови рецептори. Например, спиронолактон и еплеренон са калий-съхраняващи диуретици; те насърчават екскрецията на натрий и вода.
Хипоалдостеронизмът е дефицит на алдостерон, който се проявява при определени заболявания. Причините за първичен хипоалдостеронизъм могат да бъдат туберкулоза, автоимунно възпаление на надбъбречните жлези, туморни метастази, внезапна отмянастероиди. По правило това е недостатъчност на цялата надбъбречна кора. Остра недостатъчностможе да бъде причинено от зона гломерулна некроза, кръвоизлив или остра инфекция. Децата могат да изпитат форма на мълнияс много инфекциозни заболявания(грип, менингит), когато едно дете може да умре за един ден.
При недостатъчност на зоната гломерулоза, реабсорбцията на натрий и вода намалява и обемът на циркулиращата плазма намалява; реабсорбцията на K +, H + се увеличава. В резултат на това кръвното налягане рязко спада и електролитен балансИ киселинно-алкален баланс, състоянието е с опасност за живота. Лечение: венозно приложение солеви разтвории алдостеронови агонисти (флудрокортизон).
Ключовата връзка в RAAS е ангиотензин II, който:
Действа върху zona glomerulosa и повишава секрецията на алдостерон;
Действа върху бъбреците и предизвиква задържане на Na +, Cl - и вода;
Действа върху симпатиковите неврони и предизвиква освобождаването на норепинефрин, мощен вазоконстриктор;
Предизвиква вазоконстрикция - стеснява кръвоносните съдове (десетки пъти по-активно от норепинефрина);
Стимулира соления апетит и жаждата.
Така тази система нормализира кръвното налягане, когато то намалее. Излишъкът от ангиотензин II засяга сърцето, точно както излишъкът от CA и тромбоксани, причинява миокардна хипертрофия и фиброза, допринасяйки за хипертония и хронична сърдечна недостатъчност.
Когато кръвното налягане се повиши, започват да работят главно три хормона: NUP (натриуретични пептиди), допамин и адреномедулин. Техните ефекти са противоположни на тези на алдостерона и AT II. NUPs причиняват екскреция на Na +, Cl -, H 2 O, вазодилатация, повишават съдовата пропускливост и намаляват образуването на ренин.
Адреномедулиндейства по същия начин като NUP: това е екскрецията на Na +, Cl -, H 2 O, вазодилатация. Допаминът се синтезира от проксималните тубули на бъбреците и действа като паракринен хормон. Неговите ефекти: екскреция на Na + и H 2 O. Допаминът намалява синтеза на алдостерон, действието на ангиотензин II и алдостерон, причинява вазодилатация и увеличаване на бъбречния кръвоток. Заедно тези ефекти водят до понижаване на кръвното налягане.
Нивото на кръвното налягане зависи от много фактори: работата на сърцето, тонуса на периферните съдове и тяхната еластичност, както и обема на електролитния състав и вискозитета на циркулиращата кръв. Всичко това се контролира от нервната и хуморалната система. Хипертонична болеств процеса на хронифициране и стабилизиране е свързано с късни (ядрени) ефекти на хормоните. В този случай настъпва съдово ремоделиране, хипертрофия и пролиферация, съдова и миокардна фиброза.
Понастоящем ефективните антихипертензивни лекарства са вазопептидазни инхибитори, АСЕ и неутрална ендопептидаза. Неутралната ендопептидаза участва в разрушаването на брадикинин, NUP и адреномедулин. И трите пептида са вазодилататори и понижават кръвното налягане. Например, АСЕ инхибиторите (периндо-, еналоприл) намаляват кръвното налягане чрез намаляване на образуването на AT II и забавяне на разграждането на брадикинин.
Открити са неутрални ендопептидазни инхибитори (омапатрилат), които са едновременно АСЕ и неутрални ендопептидазни инхибитори. Те не само намаляват образуването на AT II, но също така предотвратяват разграждането на хормоните, които понижават кръвното налягане - адреномедулин, NUP, брадикинин. АСЕ инхибиторите не изключват напълно RAAS. По-пълно изключване на тази система може да се постигне с ангиотензин II рецепторни блокери (лосартан, епросартан).
За оферта:Леонова М.В. Ново и обещаващо лекарства, блокиращ системата ренин-ангиотензин-алдостерон // Рак на гърдата. Медицински преглед. 2013. № 17. С. 886
Ролята на системата ренин-ангиотензин-алдостерон (RAAS) в развитието артериална хипертония(AG) и др сърдечно-съдови заболяванияв момента се счита за доминираща. В сърдечно-съдовия континуум хипертонията е сред рисковите фактори, а основният патофизиологичен механизъм на увреждане на сърдечно-съдовата система е ангиотензин II (ATII). ATII е ключов компонент на RAAS - ефектор, който осъществява вазоконстрикция, задържане на натрий, активиране на симпатиковата нервна система, клетъчна пролиферация и хипертрофия, развитие на оксидативен стрес и възпалителни процеси съдова стена.
В момента те вече са разработени и масово клинично приложениедва класа лекарства, които блокират RAAS, са АСЕ инхибитори и ATII рецепторни блокери. Фармакологичните и клиничните ефекти на тези класове се различават. ACE е пептидаза от групата на цинковите металопротеинази, която метаболизира ATI, AT1-7, брадикинин, субстанция Р и много други пептиди. Механизъм на действие АСЕ инхибиториглавно свързано с предотвратяването на образуването на ATII, което насърчава вазодилатацията, натриурезата и елиминира провъзпалителните, пролиферативните и други ефекти на ATII. Освен това АСЕ инхибиторите предотвратяват разграждането на брадикинина и повишават нивата му. Брадикининът е мощен вазодилататор, потенцира натриурезата и най-важното е, че има кардиопротективен ефект (предотвратява хипертрофия, намалява исхемичното увреждане на миокарда, подобрява коронарното кръвоснабдяване) и вазопротективен ефект, подобрявайки ендотелната функция. По същото време, високо нивобрадикининът е причина за развитие ангиоедем, което е един от сериозните недостатъци на АСЕ инхибиторите, които повишават значително нивото на кинините.
АСЕ инхибиторите не винаги са в състояние напълно да блокират образуването на ATII в тъканите. Сега е установено, че други ензими, които не са свързани с АСЕ, също могат да участват в неговата трансформация в тъканите, предимно ендопептидази, които не се повлияват от АСЕ инхибиторите. В резултат на това АСЕ инхибиторите не могат напълно да премахнат ефектите на ATII, което може да е причината за тяхната липса на ефективност.
Решението на този проблем беше улеснено от откриването на ATII рецептори и първия клас лекарства, които селективно блокират AT1 рецепторите. Неблагоприятните ефекти на ATII се реализират чрез AT1 рецепторите: вазоконстрикция, секреция на алдостерон, вазопресин, норепинефрин, задържане на течности, пролиферация на гладкомускулни клетки и кардиомиоцити, активиране на SAS, както и механизма на отрицателни " обратна връзка" - образуване на ренин. AT2 рецепторите изпълняват "полезни" функции, като вазодилатация, процеси на възстановяване и регенерация, антипролиферативни ефекти, диференциация и развитие на ембрионални тъкани. Клинични ефекти ATII рецепторните блокери се медиират чрез елиминиране на "вредните" ефекти на ATII на ниво AT1 рецептори, което осигурява по-пълно блокиране неблагоприятни ефекти ATII и повишено влияние на ATII върху AT2 рецепторите, което допълва вазодилатиращия и антипролиферативния ефект. ATII рецепторните блокери имат специфичен ефект върху RAAS, без да се намесват в кининовата система. Липсата на влияние върху активността на кининовата система, от една страна, намалява тежестта нежелани ефекти(кашлица, ангиоедем), но, от друга страна, лишава ATII рецепторните блокери от важен антиисхемичен и вазопротективен ефект, което ги отличава от АСЕ инхибиторите. Поради тази причина показанията за употреба на ATII рецепторни блокери в голяма степен повтарят показанията за употреба на АСЕ инхибитори, което ги прави алтернативни лекарства.
Въпреки въвеждането на блокерите на RAAS в широко разпространената практика при лечението на хипертония, проблемите за подобряване на резултатите и прогнозата остават. Те включват: възможността за подобряване на контрола на кръвното налягане в популацията, ефективността на лечението на резистентна хипертония и възможността за допълнително намаляване на риска от сърдечно-съдови заболявания.
Търсенето на нови начини за въздействие върху RAAS продължава активно; Проучват се други тясно взаимодействащи системи и се създават лекарства с множество механизми на действие, като инхибитори на АСЕ и неутрална ендопептидаза (NEP), ендотелин-конвертиращ ензим (ACE) и инхибитори на NEP, инхибитори на ACE/NEP/EGT.
Вазопептидазни инхибитори
В допълнение към добре познатия АСЕ, вазопептидазите включват още две цинкови металопротеинази - неприлизин (неутрална ендопептидаза, NEP) и ендотелин-конвертиращ ензим, които също могат да бъдат мишени за фармакологично действие.
Неприлизин е ензим, произвеждан от съдовия ендотел и участващ в разграждането на натриуретичния пептид, както и на брадикинина.
Натриуретичната пептидна система е представена от три различни изоформи: предсърден натриуретичен пептид (А-тип), мозъчен натриуретичен пептид (В-тип), които се синтезират в атриума и миокарда, и ендотелен С-пептид, които са биологични функцииса ендогенни инхибитори на RAAS и ендотелин-1 (Таблица 1). Сърдечно-съдовите и бъбречните ефекти на натриуретичния пептид включват понижаване на кръвното налягане чрез ефекта му върху съдовия тонус и водно-електролитния баланс, както и антипролиферативни и антифиброзни ефекти върху целевите органи. Най-новите доказателства сочат, че натриуретичната пептидна система участва в метаболитната регулация: окисляване на липидите, образуване и диференциация на адипоцити, активиране на адипонектин, инсулинова секреция и въглехидратен толеранс, което може да осигури защита срещу развитието на метаболитен синдром.
Сега стана известно, че развитието на сърдечно-съдови заболявания е свързано с дисрегулация на натриуретичната пептидна система. По този начин при хипертония има дефицит на натриуретичен пептид, водещ до чувствителност към сол и нарушена натриуреза; при хронична сърдечна недостатъчност (CHF), на фона на дефицит, се наблюдава ненормално функциониране на хормоните на натриуретичната пептидна система.
Следователно, за потенциране на натриуретичната пептидна система, за да се постигнат допълнителни хипотензивни и защитни кардиоренални ефекти, е възможно да се използват NEP инхибитори. Инхибирането на неприлизин води до потенциране на натриуретичния, диуретичния и вазодилататорния ефект на ендогенния натриуретичен пептид и в резултат на това до понижаване на кръвното налягане. Въпреки това, NEP също участва в разграждането на други вазоактивни пептиди, по-специално ATI, ATII и ендотелин-1. Следователно, балансът на ефектите на инхибиторите на NEP върху съдовия тонус е променлив и зависи от преобладаването на констрикторните и дилататорните ефекти. При продължителна употребаАнтихипертензивният ефект на инхибиторите на неприлизин е слабо изразен поради компенсаторно активиране на образуването на ATII и ендотелин-1.
В тази връзка, комбинацията от ефектите на АСЕ инхибиторите и NEP инхибиторите може значително да потенцира хемодинамичните и антипролиферативните ефекти в резултат на комплементарния механизъм на действие, което доведе до създаването на лекарства с двоен механизъм на действие, наричани общо вазопептидаза инхибитори (Таблица 2, Фиг. 1).
Известните вазопептидазни инхибитори се характеризират с в различна степенселективност към NEP/ACE: омапатрилат - 8.9:0.5; фасидоприлат - 5.1:9.8; Сампатрилат - 8,0:1,2. В резултат на това вазопептидазните инхибитори са придобили много по-голям потенциал за постигане на хипотензивен ефект, независимо от активността на RAAS и нивото на задържане на натрий, както и в органната защита (регресия на хипертрофия, албуминурия, съдова скованост). Най-проучваният в клиничните проучвания е омапатрилат, който показва по-висока антихипертензивна ефикасност в сравнение с АСЕ инхибиторите и при пациенти със ЗСН води до повишаване на фракцията на изтласкване и подобрение клинични резултати(изследвания IMPRESS, OVERTURE), но без предимства пред АСЕ инхибиторите.
Въпреки това, големи клинични проучвания, използващи омапатрилат, показват повече висока честотаразвитие на ангиоедем в сравнение с АСЕ инхибитори. Известно е, че честотата на ангиоедем при използване на АСЕ инхибитори варира от 0,1 до 0,5% в популацията, от които 20% от случаите са животозастрашаващи, което е свързано с многократно повишаване на концентрациите на брадикинин и неговите метаболити. Резултатите от голямото многоцентрово проучване OCTAVE (n=25 302), което е специално създадено за изследване на честотата на ангиоедем, показват, че честотата на това страничен ефектпо време на лечение с омапатрилат надвишава този в групата на еналаприл - 2,17% срещу 0,68% (относителен риск 3,4). Това се обяснява с повишения ефект върху нивата на кинин със синергично инхибиране на ACE и NEP, свързано с инхибиране на аминопептидаза Р, която участва в разграждането на брадикинин.
Нов двоен вазопептидазен инхибитор, който блокира ACE/NEP, е илепатрил, който има по-висок афинитет към ACE в сравнение с NEP. При изследване на фармакодинамичните ефекти на илепатрил върху активността на RAAS и натриуретичния пептид при здрави доброволци беше установено, че лекарството зависи от дозата (в дози от 5 и 25 mg) и значително (повече от 88%) потиска ACE в кръвна плазма за повече от 48 часа, независимо от чувствителността към сол. В същото време лекарството значително повишава активността на плазмения ренин в рамките на 48 часа и намалява нивата на алдостерон. Тези резултати показват изразено и по-дълготрайно потискане на RAAS за разлика от АСЕ инхибитора рамиприл в доза от 10 mg, което се обяснява с по-значимия тъканен ефект на илепатрил върху АСЕ и по-големия афинитет към АСЕ и сравнима степен на блокадата на RAAS в сравнение с комбинацията от 150 mg ирбесартан + 10 mg рамиприл. За разлика от ефекта върху RAAS, ефектът на илепатрил върху натриуретичния пептид се проявява чрез краткотрайно повишаване на нивото на неговата екскреция в периода 4-8 часа след приема на доза от 25 mg, което показва по-ниска и по-слаб афинитет към NEP и го отличава от omapatrilat. Освен това, по отношение на нивото на екскреция на електролити, лекарството няма допълнителен натриуретичен ефект в сравнение с рамиприл или ирбесартан, както и други вазопептидазни инхибитори. Максимум хипотензивен ефектсе развива 6-12 часа след приема на лекарството, а понижението на средното кръвно налягане е 5±5 и 10±4 mmHg. съответно при ниска и висока чувствителност към сол. Според фармакокинетичните характеристики илепатрил е пролекарство с активен метаболит, който се образува бързо, достигайки максимална концентрация след 1-1,5 часа и бавно се елиминира. В момента се провеждат клинични изпитвания фаза III.
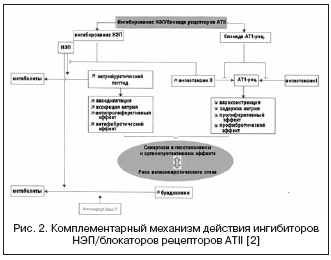
Алтернативен път за двойно потискане на RAAS и NEP е представен от комбинация от ATII и NEP рецепторна блокада (фиг. 2). ATII рецепторните блокери не повлияват метаболизма на кинините, за разлика от АСЕ инхибиторите, и следователно потенциално имат по-нисък риск от развитие на усложнения на ангиоедем. В момента във фаза III клинични изпитванияпървото лекарство е ATII рецепторен блокер с ефект на инхибиране на NEP в съотношение 1:1 - LCZ696. Комбинираната лекарствена молекула съдържа валсартан и NEP инхибитор (AHU377) под формата на пролекарство. В голямо проучване при пациенти с хипертония (n=1328), LCZ696 в дози от 200-400 mg показва предимство в хипотензивния ефект спрямо валсартан в дози от 160-320 mg под формата на допълнително понижение на кръвното налягане с 5 /3 и 6/3 mmHg. . Хипотензивният ефект на LCZ696 е придружен от по-изразено понижение на пулсовото кръвно налягане: с 2,25 и 3,32 mmHg. съответно в дози от 200 и 400 mg, което към момента се счита за положително прогностичен факторвърху ефекта върху сковаността на съдовата стена и сърдечносъдовите резултати. В същото време, изследване на неврохуморални биомаркери по време на лечение с LCZ696 показа повишаване на нивото на натриуретичния пептид със сравнима степен на повишаване на нивото на ренин и алдостерон в сравнение с валсартан. Поносимостта при пациенти с хипертония е добра и не са отбелязани случаи на ангиоедем. Проучването PARAMOUMT вече е завършено при 685 пациенти със ЗСН и неувредена EF. Резултатите от проучването показват, че LCZ696 по-бързо и по-значително намалява нивото на NT-proBNP (първичната крайна точка е маркер за повишена активност на натриуретичен пептид и лоша прогноза при ХСН) в сравнение с валсартан и също така намалява размера на левия атриум, което показва регресия на неговото ремоделиране. В момента е в ход проучване при пациенти със ЗСН и намалена ФИ (проучване PARADIGM-HF).
Инхибитори на ендотелиновата система
Ендотелиновата система играе важна роля в регулацията на съдовия тонус и регионалния кръвен поток. Сред трите известни изоформи ендотелин-1 е най-активният. В допълнение към известните вазоконстрикторни ефекти, ендотелинът стимулира пролиферацията и синтеза на междуклетъчния матрикс, а също така, поради директния си ефект върху тонуса на бъбречните съдове, участва в регулирането на водно-електролитната хомеостаза. Ефектите на ендотелина се реализират чрез взаимодействие със специфични рецептори от тип А и В, чиито функции са взаимно противоположни: вазоконстрикцията се осъществява чрез рецептори от тип А, а вазодилатацията се осъществява чрез рецептори от тип В. През последните години беше установено, че В-тип рецепторите играят важна роля в клирънса на ендотелин-1, т.е. когато тези рецептори са блокирани, рецептор-зависимият клирънс на ендотелин-1 се нарушава и концентрацията му се повишава. В допълнение, B-тип рецепторите участват в регулирането на бъбречните ефекти на ендотелин-1 и поддържането на хомеостазата на течности и електролити, което е важно.
В момента е доказана ролята на ендотелина в развитието на редица заболявания, вкл. AH, CHF, белодробна хипертония, хронични болестибъбрек; показва тясна връзка между нивата на ендотелина и метаболитен синдром, ендотелна дисфункция и атерогенеза. От 1990 г в ход е търсене на антагонисти на ендотелиновия рецептор, подходящи за клинична употреба; Вече са известни 10 лекарства („сентани”) с различна степен на селективност към A/B-тип рецептори. Първият неселективен ендотелинов рецепторен антагонист, бозентан, в клинично проучване при пациенти с хипертония показва антихипертензивна ефикасност, сравнима с тази на АСЕ инхибитора еналаприл. По-нататъшни проучвания на ефективността на употребата на ендотелинови антагонисти при хипертония показаха тяхното клинично значение при лечението на резистентна хипертония и при високо кръвно налягане. сърдечно-съдов риск. Тези данни са получени от две големи клинични изпитвания, DORADO (n=379) и DORADO-AC (n=849), при които на пациенти с резистентна хипертония е добавен дарусентан към тройна комбинирана терапия. В проучването DORADO пациентите с резистентна хипертония са комбинирани с хронично заболяванебъбреци и протеинурия, в резултат на добавянето на дарузентан се наблюдава не само значително понижение на кръвното налягане, но и намаляване на екскрецията на протеин. Антипротеинуричният ефект на антагонистите на ендотелиновия рецептор впоследствие е потвърден в проучване при пациенти с диабетна нефропатия, използващи авосентан. Въпреки това, в проучването DORADO-AS няма предимства в допълнителното понижаване на кръвното налягане в сравнение с лекарствата за сравнение и плацебо, което е причината за прекратяване допълнителни изследвания. В допълнение, 4 големи проучвания на ендотелинови антагонисти (бозентан, дарусентан, енразентан) при пациенти със ЗСН показват противоречиви резултати, което се обяснява с повишаване на концентрациите на ендотелин-1. По-нататъшното изследване на антагонистите на ендотелиновия рецептор беше спряно поради нежелани ефекти, свързани със задържане на течности (периферен оток, обемно претоварване). Развитието на тези ефекти се свързва с ефекта на ендотелиновите антагонисти върху В-тип рецептори, което промени търсенето на лекарства, които засягат ендотелиновата система по други пътища; и ендотелиновите рецепторни антагонисти в момента имат само едно показание - лечението на белодробна хипертония.
Като се има предвид голямото значение на ендотелиновата система в регулацията на съдовия тонус, се търси друг механизъм на действие чрез вазопептидаза - EPF, която участва в образуването на активен ендотелин-1 (фиг. 3). Блокирането на ACE и комбинирането му с инхибиране на NEP може ефективно да потисне образуването на ендотелин-1 и да потенцира ефектите на натриуретичния пептид. Предимствата на двойния механизъм на действие са, от една страна, предотвратяване на недостатъците на NEP инхибиторите, свързани с възможна вазоконстрикция, медиирана от активиране на ендотелин, от друга страна, натриуретичната активност на NEP инхибиторите позволява да се компенсира задържането на течности, свързано с неселективна блокада на ендотелиновите рецептори. Daglutril е двоен NEP и ACE инхибитор, който е във фаза II на клинични изпитвания. Проучванията показват изразени кардиопротективни ефекти на лекарството поради намаляване на сърдечното и съдовото ремоделиране, регресия на хипертрофия и фиброза.
Директни ренинови инхибитори
Известно е, че АСЕ инхибиторите и ATII рецепторните блокери повишават активността на ренина чрез механизъм на обратна връзка, което е причината ефективността на блокерите на РААС да се изплъзва. Ренинът представлява първата стъпка от каскадата на RAAS; той се произвежда от юкстагломерулните клетки на бъбреците. Ренинът чрез ангиотензиноген насърчава образуването на ATII, вазоконстрикцията и секрецията на алдостерон, а също така регулира механизмите за обратна връзка. Следователно инхибирането на ренина позволява да се постигне повече пълна блокада RAAS системи. Търсенето на инхибитори на ренина продължава от 1970 г.; за дълго времеНе беше възможно да се получи перорална форма на ренинови инхибитори поради ниската им бионаличност в стомашно-чревния тракт (по-малко от 2%). Първият директен инхибитор на ренин, подходящ за перорално приложение, - алискирен - е регистриран през 2007 г. Алискирен има ниска бионаличност (2,6%), дълъг полуживот (24-40 часа) и екстраренален път на елиминиране. Фармакодинамиката на алискирен е свързана с 80% понижение на нивата на ATII. В клинични проучвания при пациенти с хипертония алискирен в дози от 150-300 mg/ден води до понижение на САН с 8,7-13 и 14,1-15,8 mmHg. съответно и ДАН - със 7,8-10,3 и 10,3-12,3 mm Hg. . Хипотензивният ефект на алискирен се наблюдава при различни подгрупи пациенти, включително пациенти с метаболитен синдром, затлъстяване; по тежест той е сравним с ефекта на АСЕ инхибиторите, блокерите на ATII рецепторите, а адитивен ефект е отбелязан и в комбинация с валсартан, хидрохлоротиазид и амлодипин. Редица клинични проучвания показват органопротективните ефекти на лекарството: антипротеинуричен ефект при пациенти с диабетна нефропатия (проучване AVOID, n=599), регресия на левокамерната хипертрофия при пациенти с хипертония (проучване ALLAY, n=465). Така, в проучването AVOID, след 3 месеца лечение с лосартан в доза от 100 mg/ден и постигане на таргетното ниво на кръвното налягане (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Освен това се провеждат серия от клинични проучвания на алискирен при лечението на други сърдечно-съдови заболявания, за да се оцени ефектът върху прогнозата на пациентите: ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n=7000). ) проучвания при пациенти със ЗСН, проучването ALTITUDE при пациенти със захарен диабет и висок сърдечно-съдов риск, проучването ASPIRE при пациенти с постинфарктно ремоделиране.
Заключение
За решаване на проблемите с профилактиката на сърдечно-съдовите заболявания продължава създаването на нови лекарства със сложен множествен механизъм на действие, позволяващ по-пълна блокада на RAAS чрез каскада от хемодинамични и неврохуморални механизми за регулиране. Потенциалните ефекти на такива лекарства позволяват не само да се осигури допълнителен хипотензивен ефект, но и да се постигне контрол на кръвното налягане при пациенти с висок риск, включително резистентна хипертония. Лекарствата с множество механизми на действие демонстрират предимства в по-изразен органопротективен ефект, който ще предотврати по-нататъшно увреждане на сърдечно-съдовата система. Проучването на ползите от нови лекарства, които блокират RAAS, изисква по-нататъшни изследвания и оценка на тяхното въздействие върху прогнозата на пациенти с хипертония и други сърдечно-съдови заболявания.



Литература
1. Кембъл Д. Дж. Вазопептидазното инхибиране: нож с две остриета? // Хипертония. 2003. том. 41. С. 383-389.
2. Laurent S., Schlaich M., Esler M. Нови лекарства, процедури и устройства за хипертония // Lancet. 2012. том. 380. С. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. и др. Вазопептидазни инхибитори: нова терапевтична концепция при сърдечно-съдови заболявания? // Тираж. 2001. том. 104. С. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. и др. Инхибиране на неутралната ендопептидаза и натриуретичната пептидна система: развиваща се стратегия в сърдечно-съдовата терапия // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. и др. Сравнение на вазопептидазен инхибитор, омапатрилат и лизиноприл върху толерантността към упражнения и заболеваемостта при пациенти със сърдечна недостатъчност: рандомизирано проучване IMPRESS // Lancet. 2000. Vol. 356. С. 615-620.
6. Packer M., Califf R.M., Konstam M.A. и др. Сравнение на omapatrilat и enalapril при пациенти с хронична сърдечна недостатъчност: The Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002. том. 106. С. 920-926.
7. Warner K.K., Visconti JA, Tschampel M.M. Ангиотензин II рецепторни блокери при пациенти с индуциран от АСЕ инхибитор ангиоедем // Ann. Pharmacother. 2000. Vol. 34. С. 526-528.
8. Kostis J.B., Packer M., Black H.R. и др. Омапатрилат и еналаприл при пациенти с хипертония: проучването Omapatrilat за сърдечно-съдово лечение срещу еналаприл (OCTAVE) // Am. J. Hypertens. 2004. том. 17. С. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Фармакокинетика и фармакодинамика на вазопептидазния инхибитор AVE7688 при хора // Clin. Pharmacol. Там. 2006. том. 79. С. 49-61.
10. Gu J., Noe A., Chandra P. et al. Фармакокинетика и фармакодинамика на LCZ696, нов инхибитор на неприлизин с двойно действие на ангиотензин рецептор (ARNi) // J. Clin. Pharmacol. 2010. том. 50. С. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Намаляване на кръвното налягане с LCZ696, нов инхибитор с двойно действие на рецептора на ангиотензин II и неприлизин: рандомизирано, двойно-сляпо, плацебо-контролирано, активно сравнително проучване // Lancet. 2010. том. 375. С. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. Инхибиторът на ангиотензин рецептор неприлизин LCZ696 при сърдечна недостатъчност със запазена фракция на изтласкване: фаза 2 двойно-сляпо рандомизирано контролирано проучване // Lancet. 2012. том. 380 (9851). P. 1387-1395.
13. Левин Е.Р. Ендотелини // N. Engl. J. Med. 1995. Vol. 333. С. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. и др. Роля на ендотелин-1 при клинична хипертония: 20 години по-късно // Хипертония. 2008. том. 52. С. 452-459.
15. Burnier M., Forni V. Ендотелинови рецепторни антагонисти: място в лечението на есенциална хипертония? // Нефрол. Набиране. Трансплантация. 2011. 0: 1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R. J., Lacourciere Y. et al. Ефектът на ендотелин-рецепторен антагонист, бозентан, върху кръвното налягане при пациенти с есенциална хипертония. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998. Том. 338. С. 784-790.
17. Weber M.A., Black H., Bakris G. et al. Селективен ендотелин-рецепторен антагонист за намаляване на кръвното налягане при пациенти с резистентна на лечение хипертония: рандомизирано, двойно-сляпо, плацебо-контролирано проучване // Lancet. 2009. том. 374. С. 1423-1431.
18. Бакрис Г.Л., Линдхолм Л.Х., Блек Х.Р. и др. Различни резултати при използване на клинични и амбулаторни кръвни налягания: доклад за резистентно към дарузентан проучване за хипертония // Хипертония. 2010. том. 56. С. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Авосентан за явна диабетна нефропатия // J. Am. Soc. Нефрол. 2010. том. 21. С. 527-535.
20. Калк П., Шарковска Ю., Кашина Е. и др. Ендотелинконвертиращият ензим/неутрален ендопептидазен инхибитор SLV338 предотвратява хипертонично сърдечно ремоделиране по начин, независим от кръвното налягане // Хипертония. 2011. том. 57. С. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Потискане на ангиотензин II при хора чрез теоретично активен инхибитор на ренин Aliskiren (SPP100): сравнение с еналаприл // Хипертония. 2002. том. 39(1). P.E1-8.
22. Alreja G., Джоузеф Дж. Ренин и сърдечно-съдови заболявания: Изтощен път или нова посока? // World J. Cardiol. 2011. том. 3(3). С. 72-83.
23. Ingelfinger J.R. Алискирен и двойна терапия при захарен диабет тип 2 // N. Engl. J. Med. 2008. том. 358 (23). P. 2503-2505.
24. Pouleur A.S., Uno H., Prescott M.F., Desai A. (за изследователите на ALLAY). Потискането на алдостерона медиира регресията на левокамерната хипертрофия при пациенти с хипертония // J. Renin-Angiotensin-Aldosterone System. 2011. том. 12. С. 483-490.
25. Kelly D.J., Zhang Y., Moe G. et al. Алискирен, нов инхибитор на ренин, е ренопротективен в модел на напреднала диабетна нефропатия при плъхове // Diabetol. 2007. том. 50. С. 2398-2404.
Системни компоненти
- Ангиотензин I
- Ангиотензин II
- Проренин
- Ангиотензин конвертиращ ензим
Компоненти на системата ренин-ангиотензин (ренин-ангиотензин алдостерон).
Ренин-ангиотензин-алдестеронова каскадазапочва с биосинтеза на препроренин от ренинова иРНК в юкстагломерулни клетки и се превръща в проренин чрез разцепване на 23 аминокиселини. В ендоплазмения ретикулум проренинът претърпява гликозилиране и придобива 3-D структура, която е характерна за аспартатните протеази. Готовата форма на проренин се състои от последователност, включваща 43 остатък, прикрепен към N-края на ренин, съдържащ 339-341 остатък. Предполага се, че допълнителна проренинова последователност (просегмент) е свързана с ренина, за да се предотврати взаимодействието с ангиотензиногена. По-голямата част от проренина се освобождава свободно в системното кръвообращение чрез екзоцитоза, но част от него се превръща в ренин чрез действието на ендопептидази в секреторните гранули на юкстагломерулните клетки. Ренинът, образуван в секреторни гранули, впоследствие се освобождава в кръвния поток, но този процес е строго контролиран от налягане, Ang 2, NaCl, чрез вътреклетъчни концентрации на калциеви йони. Следователно при здрави хора обемът на циркулиращия проренин е десет пъти по-висок от концентрацията на активен ренин в плазмата. Все още обаче остава неясно защо концентрацията на неактивния прекурсор е толкова висока.
Контрол на секрецията на ренин
Активната секреция на ренин се регулира от четири независими фактора:
- бъбречният барорецепторен механизъм в аферентната артериола, който усеща промените в бъбречното перфузионно налягане.
- Промени в нивата на NaCl в дисталния нефрон. Този поток се измерва като промяна в концентрацията на Cl - от клетките на макулата денза на дисталния извит тубул на нефрона в областта, съседна на бъбречното телце.
- Стимулиране от симпатиковите нерви чрез бета-1 адренергични рецептори.
- Механизъм на отрицателна обратна връзка, реализиран чрез директното действие на ангиотензин 2 върху юкстагломерулните клетки. Секрецията на ренин се активира чрез намаляване на перфузионното налягане или нивото на NaCl и повишаване на симпатиковата активност. Ренинът се синтезира и в други тъкани, включително мозъка, надбъбречната жлеза, яйчниците, мастната тъкан, сърцето и кръвоносните съдове.
Контролът на секрецията на ренин е определящ фактор за активността на RAAS.
Механизъм на действие на ренин-ангиотензиновата система
Ренинът регулира началния етап на ограничаване на скоростта на RAAS чрез премахване на N-терминалния сегмент ангиотензиногенза образуването на биологично инертен декапептид ангиотензин 1или Ang-(1-10). Основният източник на ангиотензиноген е черният дроб. Дългосрочните повишения на нивата на ангиотензиноген в кръвта, като тези, които възникват по време на бременност, синдром на Кушинг или лечение с глюкокортикоиди, могат да причинят хипертония, въпреки че има доказателства, че хроничните повишения на плазмените концентрации на ангиотензин са частично компенсирани от намалената секреция на ренин. Неактивният декапептид Ang 1 се хидролизира ангиотензин конвертиращ ензим (ACE), който отцепва С-терминалния дипептид и по този начин образува Ang 2 октапептид, биологично активен, мощен вазоконстриктор. ACE е екзопептидаза и се секретира главно от белодробен и бъбречен ендотел и невроепителни клетки. Ензимната активност на ACE е да увеличи вазоконстрикцията и да намали вазодилатацията.
Нови данни за компонентите на ренин-ангиотензиновата система
Въпреки че Ang2 е най-биологично активният продукт на RAAS, има доказателства, че други метаболити на агиотензини 1 и 2 също могат да имат значителна активност. Ангиотензин 3 и 4 (Ang 3 и Ang 4)се образуват чрез разцепване на аминокиселини от N-края на ангиотензин 2 поради действието на аминопептидази A и N. Ang 3 и 4 най-често се произвеждат в тъкани с високо съдържание на тези ензими, например в мозъка и бъбреците. Ang 3, хептапептид, образуван от разцепването на аминокиселина от N-края, най-често се среща в централната нервна система, където Ang III играе важна роля в поддържането на кръвното налягане. Ang IVхексапептидът е резултат от по-нататъшно ензимно разцепване от AngIII. Предполага се, че Ang 2 и 4 работят съвместно. Пример е повишаването на кръвното налягане в мозъка, причинено от действието на тези ангиотензини върху AT1 рецептора. Освен това, този хемодинамичен ефект на Ang 4 изисква присъствието както на Ang2, така и на самия AT1 рецептор. Пептидите, произведени чрез разцепване на аминокиселини от С-края, също могат да имат биологична активност. Например, Ang-(1-7), хептапептиден фрагмент на ангиотензин 2, може да се образува както от Ang2, така и от Ang1 чрез действието на редица ендопептидази или чрез действието на карбоксипептидази (напр. ACE хомолог, наречен ACE2) специално на Ang2. За разлика от ACE, ACE2 не може да участва в превръщането на Ang1 в Ang2 и неговата активност не се инхибира от ACE инхибиторите (ACEI). Ang-(1-7), който функционира чрез специфични рецептори, е описан за първи път като вазодилататор и като естествен инхибитор на ACEI. Приписват му се и кардиопротективни свойства. ACE2 може също да разцепи една аминокиселина от С-края, което води до Ang-(1-9), пептид с неизвестна функция.
Рецептори за ангиотензин II
Описани са поне 4 подтипа ангиотензин рецептор.
- Първият тип AT1-R участва в осъществяването на най-голям брой установени физиологични и патофизиологични функции на ангиотензин 2. Ефект върху сърдечно-съдовата система (вазоконстрикция, повишено кръвно налягане, повишен сърдечен контрактилитет, съдова и сърдечна хипертония), ефект върху бъбреците (реабсорбция на Na+, инхибиторна екскреция на ренин), симпатикова нервна система, надбъбречна жлеза (стимулиране на синтеза на алдостерон). AT1-R рецепторът също медиира ефектите на ангиотензина върху клетъчния растеж, пролиферацията, възпалителните реакции и оксидативния стрес. Този рецептор е свързан с G протеин и съдържа седем вградени в мембраната последователности. AT1-R е широко представен в много типове клетки, насочени към Ang 2.
- Вторият тип AT2-R е широко представен по време на ембрионалното развитие на мозъка и бъбреците, след това по време на постнаталното развитие количеството на този рецептор намалява. Има доказателства, че въпреки ниското ниво на експресия в тялото на възрастни, АТ2 рецепторът може да действа като медиатор в процеса на вазодилатация и също така да има антипролиферативни и антиапоптотични ефекти в съдовата гладка мускулатура и да инхибира растежа на кардиомиоцитите. Смята се, че в бъбреците активирането на АТ2 влияе върху реабсорбцията в проксималните извити тубули и стимулира реакции, които превръщат простагландин Е2 в простагландин F2α.2,7. Въпреки това, значението на някои от тези действия, свързани с At2, остава неизследвано.
- Функциите на рецепторите от трети тип (AT3) не са напълно изяснени.
- Четвъртият тип рецептор (AT4) участва в освобождаването на инхибитора на плазминогенния активатор (под влияние на ангиотензин 2, както и 3 и 4). Счита се, че ефектите, характерни за Ang 1–7, включително вазодилатация, натриуреза, намалена пролиферация и сърдечна защита, са медиирани чрез уникални рецептори, които не се свързват с Ang 2, като MAS рецептора.
Трябва също да се отбележи, че последните данни показват съществуването на повърхностни рецептори с висок афинитет, които свързват както ренин, така и проренин. Те се намират в тъканите на мозъка, сърцето, плацентата и бъбреците (в поендотелната гладка мускулатура и мезангиума). Ефектите на такива рецептори са насочени към локално увеличаване на производството на Ang2 и задействане на извънклетъчни кинази, като MAP кинази, които включват ERK1 и ERK2. Тези данни хвърлят светлина върху Ang2-независимите механизми на клетъчен растеж, активирани от ренин и проренин.
Ефект върху други секрети
Както беше отбелязано по-рано, Ang2, чрез AT1 рецептори, стимулира производството на алдостерон от зоната гломерулоза на надбъбречната жлеза. Алдостеронът е най-важният регулатор на K+-Na+ баланса и по този начин играе важна роля в контрола на обема на течностите. Той повишава реабсорбцията на натрий и вода в дисталните извити тубули и събирателни канали (както и в дебелото черво и слюнчените и потните жлези) и по този начин предизвиква екскрецията на калиеви и водородни йони. Ангиотензин 2, заедно с извънклетъчното ниво на калиеви йони, са най-значимите регулатори на алдостерона, но синтезата на Ang2 може също да бъде причинена от ACTH, норепинефрин, ендотелин, серотонин и инхибирана от ANP и NO. Важно е също така да се отбележи, че Ang 2 е важен фактор в трофиката на zona glomerulosa на надбъбречните жлези, която без неговото присъствие може да атрофира.
Ренин
– ензим, синтезиран от юкстагломерулни клетки на бъбречни аферентни артериоли, имащ MW около 40 kDa. Образуването на ренин се проявява особено интензивно по време на бъбречна исхемия. Местоположението на юкстагломерулните клетки ги прави особено чувствителни към промени в кръвното налягане, както и към концентрацията на Na + и K + йони в течността, протичаща през бъбречните тубули. Поради тези свойства, всяка комбинация от фактори, която причинява намаляване на обема на течността (дехидратация, спад на кръвното налягане, загуба на кръв и др.) или намаляване на концентрацията на NaCl, стимулира освобождаването на ренин.
В същото време повечето регулатори на синтеза на ренин действат чрез бъбречни барорецептори.Освобождаването на ренин се влияе от състоянието на централната нервна система, както и от промените в позицията на тялото в пространството. По-специално, при преминаване от легнало положение в седнало или изправено положение (клиностатичен тест), секрецията на ренин се увеличава. Тази рефлексна реакция се причинява от повишаване на тонуса на симпатиковата част на автономната нервна система, която предава импулси към b-адренергичните рецептори на юкстагломерулните клетки.
Основният субстрат, засегнат от ренина, е ангиотензиноген– протеин, включен във фракцията на a2-глобулините и произвеждан от черния дроб. Под влияние на глюкокортикоидите и естрогените синтезът на ангиотензиноген се увеличава значително. В резултат на действието на ренина ангиотензиногенът се превръща в декапептид ангиотензиназТова съединение има изключително слаб ефект и не оказва значително влияние върху нивата на кръвното налягане.
Междувременно ангиотензиназпод влиянието на т.нар ангиотензин конвертиращ ензим (ACE)се превръща в мощен вазоконстрикторен фактор - ангиотензинII. APF(дипептид карбоксипептидаза) е интегрален протеин, разположен основно върху мембраната на ендотелните клетки, епитела, мононуклеарните клетки, нервните окончания, клетките на репродуктивните органи и др. Разтворимата форма на ACE присъства в почти всички телесни течности.
Обичайно е да се разграничават две изоформи на АСЕ. Първият от тях получи условното наименование "соматичен". Тази изоформа има MW от 170 kDa и включва хомоложни C и N домени. Втората форма на ACE („репродуктивна“) се намира в семенната течност, има MW от около 100 kDa и съответства на С-домена на първата изоформа на ACE. Всеки от 2-те посочени домена съдържа аминокиселинни остатъци, които могат да участват в образуването на връзка с цинковия атом. Такива Zn 2+ структури са типични за много металопротеинази и са основните места на взаимодействие на ензима както със субстрата, така и с АСЕ инхибиторите.
Трябва да се отбележи, че АСЕ води не само до формирането ангиотензин II,но и унищожава брадикинин –съединение, което разширява кръвоносните съдове. Следователно повишаването на кръвното налягане при излагане на ACE е свързано както с образуването на ангиотензин II, така и с разграждането на брадикинина (фиг. 32).
Важна роля за действието на АСЕ играе йонният състав и по-специално съдържанието на хлорни йони. По този начин, при високи концентрации на Cl, С домейнът на ACE хидролизира брадикинина и ангиотензин I по-бързо от N домейна. В извънклетъчните области, където концентрацията на хлоридни аниони е висока, N-доменът е отговорен основно за превръщането на ангиотензин-I. Въпреки това, вътреклетъчно, където концентрацията на Cl е ниска, N-доменът може да участва в хидролизата на други пептидни вещества.
През последните години се установява, че АСЕ играе важна роля в хемопоезата, тъй като под негово влияние се образуват хематопоетичен пептид, инхибирайки образуването на хемопоетични клетки в костния мозък.
Ролята на АСЕ в организма е разкрита при мишки без АСЕ ген. Такива животни са имали ниско кръвно налягане, различни съдови дисфункции, нарушена бъбречна структура и функция и безплодие при мъжете.
ангиотензинII
повишава кръвното налягане чрез причиняване на артериоларна констрикция и е най-мощният познат вазоактивен агент. В допълнение, чрез механизъм за обратна връзка, той инхибира образуването и освобождаването на ренин от юкстагломерулните клетки на бъбреците, което в крайна сметка трябва да възстанови нормалните нива на кръвното налягане. Под влияние ангиотензинIIпроизводството на основния минералкортикоид рязко се увеличава - алдостерон.Въпреки че това действие е директно, ангиотензин II не повлиява производството на кортизол. Основната цел на алдостерона е задържането на Na + (чрез засилване на неговата реабсорбция в бъбречните тубули) и освобождаването на K + и H + (главно през бъбреците). Тези реакции се провеждат както следва.
Алдостерон
прониква от извънклетъчната течност в цитоплазмата на клетката и там се свързва със специфичен рецептор, след което полученият комплекс (алдостерон + рецептор) прониква в ядрото. Алдостеронът също така стимулира отварянето на Na + канали, което позволява на Na + йони да навлязат в клетката през апикалната мембрана от лумена на тубула.
Увеличаването на секрецията на К + под въздействието на алдостерон се дължи на увеличаване на пропускливостта на апикалната мембрана по отношение на тези йони, поради което К + навлиза в лумена на тубула от клетката.
Задържането на Na+ в тялото, подобно на ангиотензин II, допринася за повишаване на кръвното налягане.
ангиотензинIIе способен да се свързва със специфични рецептори на гломерулните клетки на надбъбречната жлеза. Съдържанието на тези рецептори до голяма степен зависи от концентрацията на K + йони. По този начин, ако нивото на K + се повиши, тогава броят на рецепторите за ангиотензин II в гломерулните клетки се увеличава. При намаляване на концентрацията на K + йони се наблюдава обратен ефект. Следователно K + йони играят основна роля в действието на ангиотензин II върху надбъбречните жлези.
Наскоро беше установено, че ангиотензинIIе в състояние да активира макрофагите, като по този начин повишава агрегацията на тромбоцитите и ускорява съсирването на кръвта. В същото време се освобождава инхибитор на активатора плазминоген-аз (IAP-1),което може да бъде придружено от потискане на фибринолизата. А ангиотензинIIе един от факторите, допринасящи за развитието на атерогенезата, инхибирането на апоптозата и повишения оксидативен стрес в тъканите, като по този начин провокират тромбоцитната агрегация и образуването на тромби.
ангиотензинIIе в състояние да подобри функцията на миокарда, участва в биосинтезата на норепинефрин и други физиологично активни вещества. В същото време той може да действа като растежен фактор, водещ до съдова и сърдечна хипертрофия.
При някои животни и при хората ангиотензинIIпод въздействието на ензим аминопептидазисе превръща в хептапептид ангиотензинIII.При хората нивото на ангиотензин II е приблизително 4 пъти по-високо от ангиотензин III. И двете съединения влияят върху кръвното налягане и производството на алдостерон и се разграждат доста бързо от ензимите ангиотензиназа.
При тежки бъбречни заболявания, придружени от исхемия, поради повишено образуване и секреция на ренин, се наблюдава постоянно повишаване на кръвното налягане (бъбречна хипертония). Използването на АСЕ инхибитори при тези състояния води до бързо нормализиране на кръвното налягане.
В заключение трябва още веднъж да се подчертае, че ангиотензин-ренин-алдостероновата система е тясно свързана с функцията на каликреин-кининовата система, тъй като образуването на ангиотензин II и разрушаването на брадикинина се извършват под влиянието на същата. ензим - АСЕ.
